포텐쇼스태트는 어떻게 작동합니까(간단히 말해서)?
앞서 언급한 바와 같이 전위차는 작동 전극의 전위를 제어하고 전극을 통해 흐르는 전류를 측정합니다.
왜 두 개의 전극이 아닌가? 그 이유 중 하나는 우리가 두 개의 전극을 가지고있을 때 고정점에 대한 작동 전극의 전위를 측정 할 수 없기 때문입니다.
이미 언급 한 작동 전극과 전극으로 구성된 2 전극 시스템을 상상해보십시오.이 전위는 고정 된 기준점 인 기준 전극이어야합니다.
우리는 이들 전극 사이에 일정한 전위를 적용하고 전기 화학적 반응은 작동 전극에서 발생하지만,회로가 닫히고 전류가 흐를 필요가 있기 때문에 작동 전극에서 반응에 반비례하는 반응이 발생해야하며,즉 작동 전극에서 산화가 발생하면 기준 전극에서 환원이 이루어져야합니다.
전류가 일정한 전위로 흐르면 패러데이 법칙에 따라 전기화학 반응이 일어나야 한다.:
방정식 3.1/패러데이의 법칙
이 방정식은 전하를 말한다 큐 전극을 통해 흐르는 양에 비례합니다 엔 가져 가거나 준 종의 지 전극에서 전자. 에프 이다 패러데이 상수 1 몰 전자의 전하를 나타냅니다. 전류는 전극을 통해 흐르는 시간 당 전하 큐입니다.:
방정식 3.2
방정식 3.1 과 3.2 조합은 흐르는 전류가 전극에서 일어나는 반응에 연결되어 있음을 보여줍니다.:
방정식 3.3
현재가 기준 전극에 흐르고 있다는 것을 지금 상상하십시오. 이 전극에서 종의 양 엔 변환됩니다. 이 변환은 표면의 변화 또는 전극을 둘러싼 용액의 농도를 유도합니다. 그만큼 네른스트 방정식 전위 사이의 명확한 상관 관계를 보여줍니다 전자 전극과 그 주변:

방정식 3.4/네른스트 방정식
전자 0 은 산화 환원 커플 빨간색과 황소의 표준 전위입니다. 아르 자형 이다 가스 상수 과 티 온도. 주변 용액에서 산화 및 환원 된 종의 산소 및 적색의 활성은 항상 예측하기 쉬운 것은 아닙니다. 이 종종 방정식의 단순화에 이르게:

방정식 3.5
두 활동 계수 폭스와 프레드 결과 잠재력에 포함 됩니다. 온도 및 활동 계수와 같은 환경에 의존하는 매개 변수가 포함되어 있기 때문에 전자 0’은 나열 할 수 없지만 필요한 경우 각 실험에 대해 결정해야합니다. 분석 화학의 대부분의 실험은 실온에서 수행됩니다(295 케이). 이것은 또 다른 단순화를 가능하게합니다. 또한 편리함을 벗어나 로그로 전송됩니다.
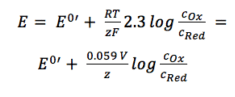
방정식 3.6
실용적인 응용 프로그램의 경우 방정식 3.6 은 네른스트 방정식의 가장 많이 사용되는 형태입니다. 많은 응용 분야에서 이자형 0 과 거의 동일 이자형 0′,둘 다 활동 계수가 하나에 가깝기 때문입니다.
이 형태(방정식 3.6)에서 전극 주변과 전위 사이의 상관 관계가 더 쉽게 보입니다.
앞서 언급한 바와 같이 식 3.4 에서 모든 단순화가 수행되었다:흐르는 전류로 인해 기준 전극을 둘러싼 용액의 변화는 우리의 고정 기준점인 것으로 추정되는 전위의 변화로 이어진다. 그러나 우리는 기준 전극을 통해 전류 흐름을 제한 할 수 없습니다(재),모든 제한은 우리가 조사 할 프로세스에 의해 발생해야하기 때문에,즉 작업 전극에서 과정(우리).
이 문제에 대한 해결책은 제 3 전극이다. 이 반대 전극(세륨),일컬어 보조 전극에,작동되는 전극의 반응에 반대 반응은 일어납니다. 작동 전극과 카운터 전극 사이에 전류가 흐르고 있습니다. 전위는 작동 전극과 기준 전극 사이에서 제어됩니다(그림 3.1 참조).

그림 3.1/회로도 3 전극 시스템
카운터와 기준 전극 사이의 전위는 작동 전극과 기준 전극 사이의 특정 전위에서 작동 전극을 통해 흐르는 전류가 만족되는 방식으로 조정됩니다. 포텐쇼스탯이 재와 우리(직류 전위 범위)와 세륨과 우리(준수 전압)사이에 적용될 수 있는 전위에는 한계가 있습니다.
당신은 재와 우리 사이의 잠재력을 제어하기 때문에 직류 전위 범위의 한계 내에서 유지하기 쉽습니다. 세륨은 수락 전압이 사용자에 의해 통제되기 수 없기 때문에,우리 보다는 더 커야 합니다. 동일한 잠재력에 더 큰 표면은 더 높은 현재로 이끌어 내고 세륨은 수락 전압으로 달리기 없이 충분한 현재를 제공해야 합니다.
엄지 손가락의 규칙은 세륨이 우리보다 100 배 더 커야한다는 것을 암시합니다. 많은 실험을 위해 이것은 필요하지 않을지도 모르지만,좋은 연습을 위해 당신은 우리에 흐르는 현재를 제한하지 않는다 그래야 세륨이 충분히 크다는 것을 확인해야 합니다.
일반적으로 세륨과 우리 사이의 거리는 충분히 커서 두 전극의 반응이 서로 영향을 미치지 않으며 반 반응은 무시할 수 있지만 때로는 작은 부피로 카운터 전극에서 어떤 반응이 일어나는지 아는 것이 도움이 될 수 있습니다.