a falon lógva a négyzetek úgy néznek ki, mint az ábécé blokkok egyenetlen fala. A betűk nem alkotnak szavakat. Az oszlopok egyenetlenek. Ez a diagram — a kémia ikonja-az elemek periódusos rendszereként ismert. Dmitrij Mendelejev (MEN-duh-LAY-ev), egy Szentpéterváron dolgozó orosz tudós korai verzióval állt elő. Ez 150 évvel ezelőtt volt. Mégis, ez a diagram még ma is segít a tudósoknak megérteni az univerzumunkat alkotó atomokat és molekulákat.
az elemek minden anyag építőkövei. Atomjaik összekapcsolódnak, hogy szó szerint mindent létrehozzanak — minket, a levegőt, amit belélegzünk, az organizmusokat, amelyek megosztják a világunkat, és minden más gázmolekulát vagy kis tömeget, amely az egész világegyetemben megtalálható.
a periódusos rendszer sorai és oszlopai az úgynevezett periódusos törvényt ábrázolják. Úgy véli, hogy a kémiai elemek közötti közös tulajdonságok rendszeres mintákban ismétlődnek, amikor az elemek nagyobbak lesznek. Ezek a minták összekapcsolják a hasonló kémiai viselkedésű elemeket, és segítenek megmondani a kémikusoknak, hogy az atomok hogyan reagálnak a molekulák kialakulására. A táblázat sorai és oszlopai a kapcsolódó elemek csoportjai közötti megosztott tulajdonságokra mutatnak. E kapcsolatok megértése segít a vegyészeknek új vegyületek létrehozásában. Ez is segít megérteni, hogyan működik az élet. Még abban is segít, hogy megjósolják, hogyan viselkednek az új anyagok.

de Mendelejev jól ismert diagramja messze nem az egyetlen periódusos rendszer. A tudósok sokat építettek, némelyik nagyon eltérő formájú. A vegyészek terveztek néhányat. Más területeken a tudósok és a tanárok másokat fejlesztettek ki.
“az alternatív formák hasznosak a tudomány különböző aspektusai miatt, amelyeket illusztrálnak” – jegyzi meg Carmen Giunta. Kémikus a Syracuse-i Le Moyne Főiskolán, New York-ban. ezek a kevésbé hagyományos periódusos rendszerek nemcsak a kémia néhány furcsaságának kiemelésére szolgálnak, hanem azt is, hogy jobban összpontosítsák őket.
pedagógusok és szülők, iratkozzon fel a Cheat Sheet
Heti frissítések, amelyek segítenek a tudományos hírek felhasználásában a diákok számára a tanulási környezetben
2019-ben a világ ünnepli a periódusos rendszer minden formáját, és hogyan segít megszervezni és megérteni univerzumunk építőköveit.
elemi
közvetlenül az ősrobbanás után az univerzum csak hidrogénből és héliumból állt — a két legkönnyebb elemből. A gravitáció ezeket az atomokat egyre nagyobb mennyiségben hozta össze. Végül ez sűrű, tüzes forró kemencéket hoz létre, amelyekről tudjuk, hogy Csillagok. Ezeknek a csillagoknak a közepén az intenzív nyomások összeolvasztották az atommagokat — az atomok központjait-nagyobb magokat hozva létre.
ez lassan kovácsolt nagyobb és nehezebb elemek. Ezek közé tartozott a szén, egy olyan elem, amely nélkülözhetetlen minden élet számára, ahogy ismerjük. Ezek a csillagkohók képezték az oxigént is, amelyet lélegeznünk kell.
a vasnál nagyobb elemek készítéséhez még több kozmikus tűzerő szükséges. A hatalmas, haldokló csillagok felrobbanásakor kialakult nehéz atommagok. Ezek a szupernóvák erőteljesen becsapták a kisebb elemeket.
1869-es periódusos rendszeréhez Mendelejev az elemeket növekvő tömeg sorrendbe rendezte. Ő volt az egyik korai tudós, aki rájött, hogy a kémia ismétlődő mintákkal rendelkezik. Ahogy az elemek nagyobbak lesznek, néhány tulajdonságuk végül megismétlődik. Bizonyos elemek inkább reagálnak, pozitív töltésűvé válnak. Néhányan inkább negatív töltésűek. Az ilyen minták lehetővé tették a tudósok számára, hogy előre jelezzék, hogy a különböző típusú elemek valószínűleg egyesülnek-e.
kutatási folyóiratában Mendelejev azt írta, hogy ennek a táblázatnak az ötlete álomban jött hozzá. Egy sorral kezdte. De ahogy a kémiai tulajdonságok megismétlődtek, új sort kezdett. A hasonló viselkedésű elemeket oszlopokba sorolta. Hézagokat hagyott. Ezek a lyukak-indokolta-olyan elemeket jelöltek meg, amelyek valószínűleg léteztek, de még nem fedezték fel őket.
amikor közzétette a táblázatot, Mendelejev négy új elem tulajdonságait és tömegét jósolta meg. Végül mind a négyet felfedezték — hármat mindössze 10 év alatt.
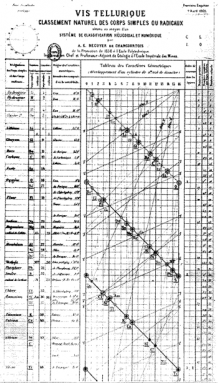
Alexandre-D. A. D. A. D. Chancourtois francia geológus volt. Hét évvel Mendelejev híres asztala előtt létrehozott egy spirál ” asztalt.”Az elemeket az atomtömeg sorrendjében rendezte el. Megmutatta az ismétlődő időszakokat. A sorok közötti szüneteket azonban nem mutatta. Ehelyett hosszú, vékony diagramját egy henger köré tekerte. Ily módon minden sor a következőbe áramlott. És hasonló elemek sorakoznak egymás fölött tiszta oszlopokban.
más tudósok hasonló diagramokat készítettek. Nem sokkal később az összes ismert elem megszervezésére irányuló erőfeszítések hógolyóztak. Ahogy ezek a diagramok fejlődtek, az egyik dominált. Ez az, amit ma a tantermekben és a tankönyvekben az egész világon látni lehet.
a 118 ismert elem mindegyikének megvan a maga kémiai szimbóluma — egy vagy két betű, amely büszkén képviseli az elem nevét a periódusos rendszer dobozából. Ezen rövidítések egy része nyilvánvaló, például h a hidrogén vagy C a szén esetében. Mások az ősi időkre nyúlnak vissza. Például a nátrium szimbóluma Na. Miért? Latinul a nátrium neve natrium.
az asztal minden dobozának egész száma van, jellemzően a bal felső sarokban. Az atomszámnak nevezett felsorolja, hogy hány proton vagy pozitív töltésű részecske van csomagolva az elem magjába. Ez a mag neutronokat is tartalmaz (tömegű, de töltés nélküli részecskék). A magot sokkal kisebb, negatív töltésű elektronok felhője veszi körül.
a diagram négyzetének alsó száma minden elemnél tizedes pont utáni számjegyeket tartalmaz. Ez az érték az elem atomtömege. Ez az elem atomjának átlagos tömegét képviseli.
a periódusos rendszer egyszerű, erőteljes, és továbbra is új kísérleteket eredményez, mondja Eric Scerri. Kémiát tanít a Los Angeles-i Kaliforniai Egyetemen. Könyveket is ír a periódusos rendszerről. A periódusos rendszer mögött meghúzódó szervezési elveket “abszolút nagy felfedezésnek” írja le.”
kettős tornyok domináltak
a mai leggyakoribb periódusos rendszert néha “ikertornyok” verziónak nevezik. Hidrogén (H) koronázza a magas tornyot a bal oldalon. Hélium (He) A jobb torony tetején.

ahogy az atomok nagyobbak lesznek, összetettebbé válnak. Ezekben a diagramokban a periódusos rendszeren belüli időszak olyan elemek sorára utal, amelyek valamilyen ismétlődő ciklust mutatnak. A táblázaton belül egy sor szélességét — más néven periódust — úgy határozzuk meg, hogy az oszlopon belüli elemek viselkedésének mintája megmaradjon. A minta először két elemben ismétlődik, így a sor két elem széles. Ezután a minta nyolc elemben ismétlődik. És ahogy az elemek egyre nagyobbak lesznek, Scerri megjegyzi: “a periódusok egyre hosszabbak” – végül 18 elemmel, majd 32-vel.
a hosszabb, nagyobb periódusok kényelmetlenül szélessé tehetik ennek az asztalnak a nehézelemes alapját. Ennek megkerülése érdekében az ikertorony diagram általában kihúzza az alsó két sor egy részét. Ezeket az elemeket az oldal aljára helyezi, majdnem olyan, mint a lábjegyzetek. Ezek az alsó sorok a lantanidok (LAN-tha-nydes) és az aktinidok (AK-tih-nydes) néven ismert elemcsoportokat tartalmazzák.
az aktinidok a legújabb és legnagyobb elemeket tartalmazzák. Sokuk radioaktív, és nem fordulnak elő a természetben. A fizikusok ehelyett laboratóriumokban készítik őket úgy, hogy kisebb elemeket bombáznak egymásba. Ezek a radioaktív, szuper nehéz elemek szintén szuper instabilak. Ez azt jelenti, hogy a másodperc törtrészein belül kisebb elemekre esnek szét.
hogyan hasznosak
a periódusos rendszer egyfajta receptkönyvként szolgálhat. Az ábra azt mutatja, hogy az elemek hogyan kapcsolódnak egymáshoz. Tehát, ha egy elem az asztalon ül, elmondja a vegyésznek, hogyan léphet kölcsönhatásba más összetevőkkel. Gyakran ezek a hasznos tulajdonságok közé tartozik a tömege, forráspontja és más fontos adatok.
a táblázat elrendezése segít a vegyészeknek a problémák megoldásában. Például a vegyészek egy új vegyületet szeretnének készíteni, amely hasonló tulajdonságokkal rendelkezik, mint egy meglévő — csak jobb. Tehát hasonló tulajdonságokkal rendelkező helyettesítőt kereshetnek, kezdve az asztal ugyanazon oszlopának egy másik elemével.
ezeknek az asztaloknak az igazi ajándéka, mondja Brigitte van Tiggelen, hogy “minden információ egy helyen van, és tanítja és megosztja azokat.”Történész, a Philadelphiai (Pa) tudománytörténeti Intézet Európai igazgatójaként dolgozik.
az ikertorony-diagramnak számos előnye van-mondja Mark Leach. Kémikus Angliában a Manchester Metropolitan Egyetemen. Egyetlen más táblázat sem képes olyan jól megmutatni az ismétlődő mintákat, állítja, miközben más funkciókat is tartalmaz.
például az összes fém a bal oldalon található. A nemfémek jobbra lógnak. Ez a diagram azt is megmutatja, hogyan változik az atom mérete, és milyen könnyen adja fel az elektront. Ezek a tulajdonságok fontosak annak megértésében, hogy az atomok hogyan viselkednek, reagálnak és házasodnak össze másokkal, hogy molekulákat alkossanak.

de a twin towers diagram nem tökéletes.
a vegyészek gyakran vitatkoznak azon, hogy hol helyezzék el például a hidrogént és a héliumot. És egy lapos, kétdimenziós táblázat nem igazán mutatja meg, hogy a sorok hogyan kapcsolódnak egymáshoz. Ahogy az egyik sor végére érsz, Scerri azt mondja: “az az érzésed van, hogy valahogy leesel.”
Roy Alexander kiállításépítőként dolgozott. Nem tetszett neki, hogy az ikertorony asztal sorai hirtelen véget értek. Tehát 1965-ben csíkokra vágta a hagyományos periódusos táblázatot. Aztán újra összerakta őket, létrehozva egy 3D verziót.
évekkel később megtudta, hogy George Gamow fizikus az 1940-es években szinte azonos táblázatot készített. Alexander így emlékszik vissza: “elképesztő volt, mennyire azonos volt a szabadalmi rajzommal.”
figyelembe véve az egyre nagyobb periódusokat
amikor B .. Dguyer de Chancourtois először létrehozta periódusos rendszerét, a legnagyobb elemek közül sokat még nem fedeztek fel. Ahogy az elemek nagyobbak lesznek,a megosztott tulajdonságok ritkábban ismétlődnek. Végül a hosszabb sorok a lantanid és aktinid elemekkel kínosan szélessé tették a hagyományos táblázatot.
egy 3D-s táblázat beépítheti ezeket a hosszabb sorokat azáltal, hogy egyszerűen szélesebbé teszi a spirált. Fernando Dufour kanadai kémikus tervezte az ElemenTree-t ennek illusztrálására (lásd a fotót). Minden periódust hatszögletű rétegként készített, amely az összes elemet tartalmazta, amelyek általában egy sorban jelennek meg az ikertorony diagramján. Hasonló elemek még mindig függőlegesen állnak.

de a fa alakú asztal nem az egyetlen 3D-s válasz. Az 1950-es években Jennie Clauson Kémiatanár egy hengerre támaszkodott az asztalához. De ahelyett, hogy kidudorodna az extra elemek, néhányat a központ felé húzott.
az ikertorony asztal másik problémája az, hogy hová tegyük a hidrogént és a héliumot. A hidrogén néha inkább fémként viselkedik. Leadja az elektronját, és vonzza a negatív töltésű ionokat. Máskor úgy viselkedik, mint egy nemfémes, és megragad egy extra elektront, és negatív töltésűvé válik. Ezután úgy viselkedik, mint egy fluor vagy klór, és felszívja a pozitív ionokat.
ennek magyarázatára Theodor Benfey kémikus az 1960-as években készített egy lapos spiráltáblát, amely hidrogént és héliumot helyezett egy nagy kék kör közepére. A körön belüli három külső küllő mindegyike hasonló elemek csoportját képviseli. A nagyobb elemek és a növekvő periodikus ciklusok beépítéséhez teraszokat adott hozzá, amelyek kidudorodnak a körből. Ezek közé tartoznak az átmeneti fémek, a lantanidok és az aktinidok.
az ikertornyokhoz hasonló lapos asztal kényelmes falra akasztáshoz vagy könyvbe nyomtatáshoz. Leach azonban hozzáteszi: “valójában nincs oka annak, hogy a periódusos rendszer nem háromdimenziós.”
szórakozás és játékok?
a periódusos rendszerek növekvő könyvtárának egyik legújabb kiegészítése az Európai kémiai társaságtól vagy az ECS-től származik. A brüsszeli székhelyű ECS célja, hogy felhívja a figyelmet számos fontos elem viszonylagos hiányára. Megjegyzi, hogy 30 elemek bemegy, hogy egy tipikus mobiltelefon. Ezen elemek közül sok nem széles körben elérhető.
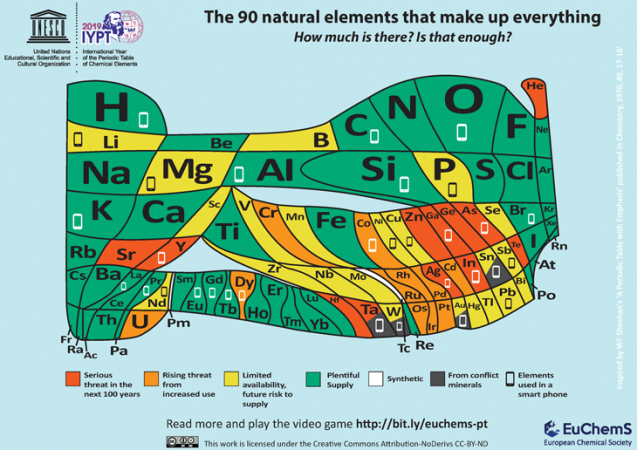
“gondosan meg kell vizsgálnunk az ilyen tárgyak pazarlására és helytelen újrahasznosítására irányuló tendenciáinkat” – érvel az ECS. “Ha nincs megoldás, akkor azt kockáztatjuk, hogy a körülöttünk lévő világot alkotó természeti elemek közül sok elfogy — akár a korlátozott készlet, a konfliktusövezetekben való elhelyezkedésük, akár a teljes újrahasznosításra való képtelenség miatt.”
az ECS elismeri, hogy ez az új táblázat “elgondolkodtató.”És ez nem véletlen. Azt akarja, hogy az emberek megértsék a “veszélyeztetett elemek” pazarlásának értékét.”Mindenkinek meg kell kérdőjeleznie, hogy valóban szükség van-e a telefonok és más elektronikus eszközök frissítésére.”És amikor az elektronikánk elpusztul, azt mondja:” gondoskodnunk kell arról, hogy újrahasznosítsuk, hogy a viszonylag szűkös elemek ne kerüljenek hulladéklerakókba vagy szennyezzék a környezetet.”
annak feltárására, hogy az emberek hogyan használják az elemeket, az ECS kifejlesztett egy ingyenes online videojátékot: Elementary Escapades.
rengeteg hely van több új periódusos rendszer számára, mondja Leach Manchesterben. Valójában hobbija az újak gyűjtése és online közzététele. Mindig keresi a régieket is. “Valószínűleg minden héten kapok egy újat” – mondja.
Scerri volt a diákok újakat is. “Mindegyiknek-mondja-Van valami kis erénye.”