Pendurado Na Parede, os quadrados parecem uma parede irregular de blocos do alfabeto. As letras não formam palavras. As colunas são desiguais. Este gráfico-um ícone da química-é conhecido como a Tabela Periódica dos elementos. Dmitri Mendeleev (MEN-duh-LAY-ev), um cientista russo que trabalha em São Petersburgo, apresentou uma versão inicial. Isso foi há 150 anos. Ainda hoje, esse gráfico ajuda os cientistas a entender os átomos e moléculas que compõem nosso universo.
elementos são os blocos de construção de toda a matéria. Seus átomos se unem para formar literalmente tudo — nós, o ar que respiramos, os organismos que compartilham nosso mundo e todas as outras moléculas de gás ou bit de massa encontrados em todo o nosso universo.
as linhas e colunas na tabela periódica mapeiam a chamada lei periódica. Ele sustenta que traços compartilhados entre elementos químicos se repetem em padrões regulares à medida que os elementos aumentam. Esses padrões ligam elementos com comportamentos químicos semelhantes e ajudam a dizer aos químicos como os átomos reagem para formar moléculas. Como as linhas e colunas nesta tabela se alinham aponta para traços compartilhados entre grupos de elementos relacionados. Compreender essas relações ajuda os químicos a criar novos compostos. Também os ajuda a entender como a vida funciona. Até os ajuda a prever como os novos materiais se comportarão.

mas o conhecido gráfico de Mendeleev está longe de ser a única tabela periódica. Os cientistas construíram muitos, alguns com formas amplamente variadas. Químicos projetaram alguns. Cientistas e professores em outros campos desenvolveram outros.”Formas alternativas são úteis por causa dos diferentes aspectos da ciência que ilustram”, observa Carmen Giunta. Ele é químico no Le Moyne College em Syracuse, NY. essas tabelas periódicas menos tradicionais fornecem maneiras não apenas de destacar algumas das peculiaridades da química, diz ele, mas também de trazê-las para um melhor foco.
os Educadores e os Pais, inscreva-se para O Cheat Sheet
atualizações Semanais para ajudar você a usar Notícias de Ciência para os Alunos no ambiente de aprendizagem
Em 2019, o mundo está comemorando a tabela periódica em todas as suas formas e como ele ajuda a organizar e dar sentido a blocos de construção do nosso universo.
É elementar
logo após o Big Bang, o universo era composto apenas de hidrogênio e hélio, os dois elementos mais leves. A gravidade reuniu esses átomos em quantidades cada vez maiores. Eventualmente, isso criaria fornos quentes densos e ardentes que conhecemos como estrelas. No centro dessas estrelas, pressões intensas fundiram núcleos atômicos — os centros dos átomos-criando núcleos maiores.
isso forjou lentamente elementos maiores e mais pesados. Eles incluíam carbono, um elemento essencial para toda a vida como a conhecemos. Essas forjas estelares também formaram o oxigênio que precisamos respirar.
fazer elementos maiores que o ferro exigia ainda mais poder de fogo cósmico. Núcleos atômicos pesados se formaram quando estrelas massivas e moribundas explodiram. Essas supernovas batiam com força elementos menores juntos.
para sua tabela periódica de 1869, Mendeleev organizou os elementos em ordem de massa ascendente. Ele foi um dos primeiros cientistas que percebeu que a química tem padrões repetidos. À medida que os elementos ficam maiores, algumas de suas propriedades eventualmente se repetem. Certos elementos preferem reagir, tornando-se carregados positivamente. Alguns preferem ser carregados negativamente. Tais padrões permitiram aos cientistas antecipar se ou como diferentes tipos de elementos provavelmente se combinariam.
em seu diário de pesquisa, Mendeleev escreveu que a ideia para esta tabela veio a ele em um sonho. Ele começou com uma linha. Mas, à medida que as propriedades químicas se repetiam, ele começou uma nova linha. Ele alinhou elementos com comportamentos semelhantes em colunas. Ele deixou lacunas. Esses buracos, ele raciocinou, marcaram elementos que provavelmente existiam, mas ainda não haviam sido descobertos.
quando ele publicou essa tabela, Mendeleev previu as propriedades e massas de quatro novos elementos. Eventualmente, todos os quatro foram descobertos-três em apenas 10 anos.
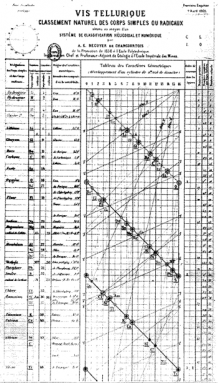
Alexandre-Émile Béguyer de Chancourtois foi um geólogo francês. Sete anos antes da famosa mesa de Mendeleev, ele criou uma “mesa” em espiral.”Ele organizou elementos em ordem de peso atômico. Mostrou os períodos de repetição. No entanto, não mostrou quebras entre as linhas. Em vez disso, ele enrolou sua longa e fina carta em torno de um cilindro. Desta forma, cada linha fluiu para a próxima. E elementos semelhantes alinhados um acima do outro em colunas limpas.
outros cientistas criaram gráficos semelhantes. Em pouco tempo, os esforços para organizar todos os elementos conhecidos snowballed. À medida que todos esses gráficos evoluíram, um subiu para dominar. É o que é visto hoje em salas de aula e livros didáticos em todo o mundo.Cada um dos 118 elementos conhecidos tem seu próprio símbolo químico-uma ou duas letras que orgulhosamente representam o nome do elemento de sua caixa na tabela periódica. Algumas dessas abreviações são óbvias, como H para hidrogênio ou C para carbono. Outros datam dos tempos antigos. Por exemplo, o símbolo do sódio é Na. Por quê? Em latim, o nome de sódio é natrium.
cada caixa na mesa tem um número inteiro, normalmente no canto superior esquerdo. Chamado de número atômico, ele lista quantos prótons, ou partículas carregadas positivamente, são embalados no núcleo do elemento. Esse núcleo também inclui nêutrons (partículas com massa, mas sem carga). Ao redor do núcleo há uma nuvem de elétrons muito menores e carregados negativamente.
o número inferior no quadrado do gráfico para cada elemento inclui dígitos após um ponto decimal. Este valor é a massa atômica do elemento. Representa a massa média de um átomo desse elemento.A tabela periódica é simples, poderosa e continua a produzir novos experimentos, diz Eric Scerri. Ele ensina química na Universidade da Califórnia, Los Angeles. Ele também escreve livros sobre a tabela periódica. Ele descreve os princípios de organização por trás da tabela periódica como ” uma descoberta absolutamente importante.”
as torres Duplas passaram a dominar
a tabela periódica mais comum de hoje às vezes é conhecida como a versão “torres gêmeas”. Hidrogênio (H) coroa a torre alta à esquerda. Hélio (ele) no topo da torre direita.

à medida que os átomos aumentam, eles se tornam mais complexos. Nestes gráficos, um período dentro da tabela periódica refere-se a uma linha de elementos que exibem algum ciclo de repetição. Dentro da tabela, a largura de uma linha — também chamada de período — é determinada para que o padrão do comportamento dos elementos dentro de uma coluna seja mantido. O padrão primeiro se repete em dois elementos, de modo que a linha tenha dois elementos de largura. Em seguida, o padrão se repete em oito elementos. E à medida que os elementos ficam maiores, observa Scerri, “os períodos ficam cada vez mais longos” — eventualmente com 18 elementos e, em seguida, 32.
os períodos mais longos e maiores poderiam tornar a base de elementos pesados desta tabela desajeitadamente ampla. Para contornar isso, o gráfico de torre dupla geralmente puxa parte das duas linhas inferiores. Ele coloca esses elementos na parte inferior da Página, quase como notas de rodapé. Essas linhas inferiores contêm grupos de elementos conhecidos como lantanídeos (LAN-tha-nydes) e actinídeos (AK-tih-nydes).Os actinídeos incluem os elementos mais novos e maiores. Muitos são radioativos e não ocorrem naturalmente. Os físicos, em vez disso, os fazem em laboratórios bombardeando elementos menores uns nos outros. Esses elementos radioativos e superpesados também são super instáveis. Isso significa que eles se desfazem em elementos menores em frações de segundo.
Como eles são úteis
Uma tabela periódica pode servir como uma espécie de livro de receitas. O gráfico mostra como os elementos se relacionam entre si. Então, onde um elemento se senta na mesa diz a um químico como ele pode ou não interagir com outros ingredientes. Muitas vezes, essas características úteis incluem sua massa, ponto de ebulição e outros dados importantes.
o arranjo da tabela ajuda os químicos a resolver problemas. Por exemplo, os químicos podem querer fazer um novo composto com características semelhantes às existentes — apenas melhor. Portanto, eles podem procurar um substituto com recursos semelhantes, começando com outro elemento da mesma coluna na tabela.
o verdadeiro presente dessas tabelas, diz Brigitte Van Tiggelen, é ” ter todas as informações em um só lugar e ensiná-las e compartilhá-las.”Historiadora, ela trabalha como diretora Europeia do Science History Institute na Filadélfia, Pa.
o gráfico de Torres Gêmeas tem muitas vantagens, diz Mark Leach. Ele é químico na Inglaterra na Manchester Metropolitan University. Nenhuma outra tabela consegue mostrar os padrões de repetição tão bem, ele argumenta, o tempo todo, incluindo outros recursos.
por exemplo, todos os metais estão no lado esquerdo. Não-metais sair à direita. Este gráfico também mostra como o tamanho de um átomo muda e com que facilidade ele provavelmente desistirá de um elétron. Tais características são importantes para entender como os átomos agirão, reagirão e se casarão com outras pessoas para formar moléculas.

mas o gráfico das torres gêmeas não é perfeito.
químicos frequentemente discutem sobre onde colocar hidrogênio e hélio, por exemplo. E uma tabela plana e bidimensional realmente não mostra como as linhas se conectam umas às outras. Ao chegar ao final de uma linha, Scerri diz: “você tem a sensação de que meio que cai.”
Roy Alexander trabalhou como construtor de exposições. Ele não gostou da maneira como as fileiras da mesa da torre gêmea terminaram abruptamente. Então, em 1965, ele cortou um gráfico de tabela periódica tradicional em tiras. Então ele os colocou de volta juntos, criando uma versão 3-D.Anos depois, ele aprendeu que o físico George Gamow construiu uma tabela quase idêntica na década de 1940. Lembra Alexander, ” foi incrível o quão idêntico parecia ao meu desenho de patente.”
contabilizando os períodos cada vez maiores
quando Béguyer de Chancourtois criou sua tabela periódica pela primeira vez, muitos dos maiores elementos ainda não haviam sido descobertos. À medida que os elementos aumentam, os traços compartilhados se repetem com menos frequência. Eventualmente, as linhas mais longas com os elementos lantanídeo e actinídeo tornaram o gráfico tradicional desajeitadamente amplo.
uma tabela 3-D pode incorporar essas linhas mais longas simplesmente tornando a espiral mais larga. O químico Canadense Fernando Dufour projetou ElemenTree para ilustrar isso (veja a foto). Ele fez cada período Como UMA camada hexagonal que continha todos os elementos que geralmente apareciam em uma única linha no gráfico de Torre Dupla. Elementos semelhantes ainda se alinham verticalmente.

mas uma mesa em forma de árvore não é a única resposta 3-D. Na década de 1950, a professora de química Jennie Clauson confiou em um cilindro para sua mesa. Mas em vez de abaulamento elementos extras para fora, ela colocou alguns deles em direção ao centro.
outro problema com a mesa de torre dupla é onde colocar hidrogênio e hélio. O hidrogênio às vezes age mais como um metal, por exemplo. Ele vai lançar seu elétron e atrair íons carregados negativamente. Outras vezes, ele age como um não-metal e pega um elétron extra e fica carregado negativamente. Então ele age mais como um flúor ou cloro e esponjas íons positivos.
para explicar isso, o químico Theodor Benfey criou uma tabela espiral plana na década de 1960. colocou hidrogênio e hélio no meio de um grande círculo azul. Cada um dos três raios externos dentro do círculo representa um grupo de elementos semelhantes. Para incluir os elementos maiores e os ciclos periódicos crescentes, ele acrescentou terraços que se projetam para fora do círculo. Eles incluem os metais de transição, lantanídeos e actinídeos.
uma mesa plana como as torres gêmeas é conveniente para pendurar em uma parede ou imprimir em um livro. No entanto, Leach acrescenta: “não há realmente nenhuma razão pela qual a tabela periódica não seja tridimensional.”
diversão e jogos?
uma das últimas adições à crescente biblioteca de tabelas periódicas vem da European Chemical Society, ou ECS. Com sede em Bruxelas, Bélgica, a ECS pretende chamar a atenção para a relativa escassez de muitos elementos importantes. Ele observa que 30 elementos entram em fazer um telefone celular típico. E muitos desses elementos não estão amplamente disponíveis.
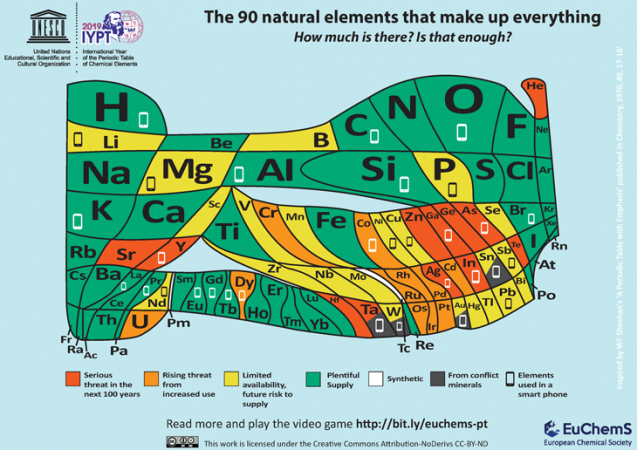
“é necessário examinar cuidadosamente nossas tendências de desperdiçar e reciclar indevidamente esses itens”, argumenta o ECS. “A menos que soluções sejam fornecidas, corremos o risco de ver muitos dos elementos naturais que compõem o mundo ao nosso redor acabarem — seja por causa de suprimentos limitados, sua localização em áreas de conflito ou nossa incapacidade de reciclá-los completamente.”
o ECS reconhece que esta nova tabela é ” instigante.”E isso não é por acaso. Ele quer que as pessoas entendam o valor de não desperdiçar ” elementos ameaçados.”Todo mundo, diz ele, precisa “questionar se as atualizações para nossos telefones e outros dispositivos eletrônicos são realmente necessárias.”E quando nossa eletrônica morre, ela diz: “Precisamos nos certificar de que reciclamos” para que elementos relativamente escassos “não acabem em aterros sanitários ou poluam o meio ambiente.”
para explorar como as pessoas usam elementos, o ECS desenvolveu um videogame online gratuito: Elementary Escapades.Há muito espaço para mais novas tabelas periódicas, diz Leach em Manchester. Na verdade, ele fez um hobby de colecionar novos e publicá-los online. Ele está sempre à procura de velhos, também. “Eu provavelmente recebo um novo a cada semana”, diz ele.
Scerri fez com que os alunos desenvolvessem novos também. “Cada um”, diz ele, ” tem alguma pequena virtude própria.”