cum funcționează un Potențiostat (pe scurt)?
așa cum am menționat anterior, un potențiostat controlează potențialul electrodului de lucru și măsoară curentul care curge prin el.
de ce nu doar doi electrozi? Unul dintre motive este că nu putem măsura potențialul electrodului de lucru împotriva unui punct fix atunci când avem doar doi electrozi.
Imaginați-vă un sistem cu doi electrozi care constă din electrodul de lucru deja menționat și electrodul, care potențial ar trebui să fie punctul nostru de referință fix, electrodul de referință.
aplicăm un anumit potențial între acești electrozi și o reacție electrochimică are loc la electrodul de lucru, dar din moment ce circuitul trebuie închis și curentul trebuie să curgă, trebuie să apară o reacție inversă reacției la electrodul de lucru, adică dacă oxidarea are loc la electrodul de lucru, trebuie să aibă loc o reducere la electrodul de referință.
dacă un curent curge la un potențial constant, o reacție electrochimică trebuie să se întâmple conform legii lui Faraday:
ecuația 3.1 / Legea lui Faraday
această ecuație spune că sarcina Q care curge printr-un electrod este proporțională cu cantitatea n a unei specii care a luat sau a dat electroni z la electrod. F este constanta Faraday și reprezintă sarcina de 1 electroni mol. Curentul I este sarcina Q pe timpul t care curge prin electrod:
ecuație 3.2
ecuațiile 3.1 și 3.Combinația 2 arată că curentul i care curge este conectat la reacția care are loc la electrod prin cantitatea n:
ecuație 3.3
Imaginați-vă acum că curentul curge la electrodul de referință. La acest electrod se convertește o cantitate de n a speciei. Această conversie duce la o schimbare a suprafeței sau a concentrației soluției care înconjoară electrodul. Ecuația Nernst arată o corelație clară între potențialul E al unui electrod și împrejurimile sale:

ecuația 3.4 / ecuația Nernst
E0 este potențialul standard al cuplului redox roșu și Bou. R este constanta gazului și T temperatura. Activitatea formei oxidate și reduse a speciilor aOx și aRed în soluția înconjurătoare nu este întotdeauna ușor de prezis. Acest lucru duce adesea la o simplificare a ecuației:

ecuație 3.5
cei doi coeficienți de activitate fOx și fRed sunt incluși în potențialul rezultat E0′, care se numește potențial formal. Deoarece conține parametri care depind de mediu, cum ar fi coeficienții de temperatură și activitate, E0′ nu poate fi listat, dar trebuie determinat pentru fiecare experiment, dacă este necesar. Cele mai multe experimente în chimia analitică sunt efectuate la temperatura camerei (295 K). Acest lucru face posibilă o altă simplificare. Din comoditate, de asemenea, ln va fi transferat în jurnal.
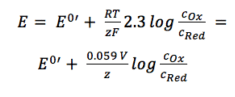
ecuație 3.6
pentru aplicarea practică ecuația 3.6 Este cea mai utilizată formă a ecuației Nernst. Pentru multe aplicații se poate presupune că E0 este aproximativ același cu E0′, deoarece ambii coeficienți de activitate sunt apropiați de unul.
în această formă (ecuația 3.6) corelația dintre înconjurarea unui electrod și potențialul său este vizibilă mai ușor.
după cum s-a menționat anterior, s-au efectuat toate simplificările la ecuația 3.4: schimbarea soluției din jurul electrodului de referință, datorită unui curent care curge, duce la o schimbare a potențialului care se presupune a fi punctul nostru de referință fix. Dar nu putem limita fluxul de curent prin electrodul de referință (RE), deoarece toate limitările ar trebui să fie cauzate de procesul pe care dorim să îl investigăm, adică procesul la electrodul de lucru (noi).
soluția pentru această problemă este un al treilea electrod. La acest contor electrod (CE), cunoscut și sub numele de electrod auxiliar, are loc contra-reacția la reacțiile electrodului de lucru. Curentul curge între electrodul de lucru și contor. Potențialul este controlat între electrodul de lucru și cel de referință (a se vedea figura 3.1).

figura 3.1 / un sistem schematic cu trei electrozi
potențialul dintre contor și electrodul de referință este reglat astfel încât curentul care curge prin electrodul de lucru la un anumit potențial între electrodul de lucru și cel de referință este satisfăcut. Există limite pentru potențialul pe care un potențiostat îl poate aplica între RE și WE (gama de potențial DC) și CE și WE (tensiunea de conformitate).
din moment ce controlați potențialul dintre RE și noi, este ușor să rămâneți în limitele intervalului potențial DC. CE trebuie să fie mai mare decât WE, deoarece tensiunea de conformitate nu poate fi controlată de utilizator. O suprafață mai mare la același potențial duce la un curent mai mare, iar CE ar trebui să furnizeze suficient curent fără a intra în tensiunea de conformitate.
o regulă generală sugerează că CE ar trebui să fie de 100 de ori mai mare decât WE. Pentru multe experimente, acest lucru poate să nu fie necesar, dar pentru o bună practică trebuie să vă asigurați că CE este suficient de mare pentru a nu limita curentul care curge la WE.
de obicei, distanța dintre CE și WE este suficient de mare, astfel încât reacțiile celor doi electrozi să nu se influențeze reciproc, iar contra-reacția poate fi ignorată, dar uneori, în volume mici, de exemplu, poate fi util să știm ce reacție se întâmplă la contra-electrodul.