Hur fungerar en Potentiostat (i ett nötskal)?
som tidigare nämnts styr en potentiostat potentialen hos arbetselektroden och mäter strömmen som strömmar genom den.
varför inte bara två elektroder? En av anledningarna är att vi inte kan mäta arbetselektrodens potential mot en fast punkt när vi bara har två elektroder.
Föreställ dig ett tvåelektrodsystem som består av den redan nämnda arbetselektroden och elektroden, vilken potential ska vara vår fasta referenspunkt, referenselektroden.
vi tillämpar en viss potential mellan dessa elektroder och en elektrokemisk reaktion sker vid arbetselektroden, men eftersom kretsen måste stängas och strömmen måste flöda måste en reaktion som är invers mot reaktionen vid arbetselektroden inträffa, det vill säga om oxidation sker vid arbetselektroden måste en reduktion ske vid referenselektroden.
om en ström flyter med en konstant potential måste en elektrokemisk reaktion ske enligt Faradays lag:
ekvation 3.1 / Faradays lag
denna ekvation säger att laddningen Q som strömmar genom en elektrod är proportionell mot mängden n av en art som tog eller gav z-elektroner vid elektroden. F är Faraday-konstanten och representerar laddningen av 1 mol elektroner. Strömmen i är laddningen Q Per tid t som strömmar genom elektroden:
ekvation 3.2
ekvationerna 3.1 och 3.2 kombination visar att strömmen i som flyter är ansluten till reaktionen som händer vid elektroden via mängden n:
ekvation 3.3
Föreställ dig nu att strömmen strömmar vid referenselektroden. Vid denna elektrod omvandlas en arts mängd n. Denna omvandling leder till en förändring av ytan eller koncentrationen av lösningen som omger elektroden. Nernst-ekvationen visar en tydlig korrelation mellan potentialen E för en elektrod och dess omgivning:

ekvation 3.4 / Nernst ekvation
E0 är standardpotentialen för redoxparet Red och Ox. R är gaskonstanten och t temperaturen. Aktiviteten hos den oxiderade och reducerade formen av arten aOx och aRed i den omgivande lösningen är inte alltid lätt att förutsäga. Detta leder ofta till en förenkling av ekvationen:

ekvation 3.5
de två aktivitetskoefficienterna fOx och fRed ingår i den resulterande potentialen E0′, som kallas den formella potentialen. Eftersom det innehåller parametrar som är beroende av miljön, såsom temperatur och aktivitetskoefficienter, kan E0′ inte listas utan måste bestämmas för varje experiment, om det behövs. De flesta experiment i analytisk kemi utförs vid rumstemperatur (295 K). Detta möjliggör en annan förenkling. Av bekvämlighet kommer även ln att överföras till loggen.
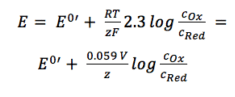
ekvation 3.6
för praktisk tillämpning ekvation 3.6 är den mest använda formen av Nernst ekvationen. För många applikationer kan man anta att E0 är ungefär samma som E0′, eftersom båda aktivitetskoefficienterna är nära en.
i denna form (ekvation 3.6) är korrelationen mellan omgivningen av en elektrod och dess potential lättare synlig.
som tidigare nämnts utfördes alla förenklingar vid ekvation 3.4: förändringen av lösningen som omger referenselektroden, på grund av en flytande ström, leder till en förändring av potentialen som ska vara vår fasta referenspunkt. Men vi kan inte begränsa strömflödet genom referenselektroden (RE), eftersom alla begränsningar bör orsakas av den process som vi vill undersöka, det vill säga processen vid arbetselektroden (vi).
lösningen på detta problem är en tredje elektrod. Vid denna motelektrod (CE), även känd som hjälpelektroden, sker motreaktionen mot arbetselektrodens reaktioner. Strömmen strömmar mellan arbets-och motelektroden. Potentialen styrs mellan arbets-och referenselektroden (se figur 3.1).

figur 3.1 / ett schematiskt treelektrodsystem
potentialen mellan räknaren och referenselektroden justeras på ett sådant sätt att strömmen som strömmar genom arbetselektroden vid en viss potential mellan arbets-och referenselektroden är nöjd. Det finns gränser för potentialen en potentiostat kan tillämpas mellan RE och vi (DC potential range) och CE och vi (överensstämmelse spänning).
eftersom du kontrollerar potentialen mellan RE och vi är det lätt att hålla sig inom gränserna för DC-potentialområdet. CE måste vara större än WE, eftersom överensstämmelsesspänningen inte kan styras av användaren. En större yta med samma potential leder till en högre ström och CE bör ge tillräckligt med ström utan att köra in i överensstämmelsesspänningen.
en tumregel antyder att CE bör vara 100 gånger större än WE. För många experiment kan detta inte vara nödvändigt, men för en god praxis bör du se till att CE är tillräckligt stor så att den inte begränsar strömmen som strömmar vid WE.
vanligtvis är avståndet mellan CE och vi tillräckligt stort så att reaktionerna hos de två elektroderna inte påverkar varandra, och motreaktionen kan ignoreras, men ibland kan det i små volymer till exempel vara till hjälp att veta vilken reaktion som händer vid motelektroden.