Wie funktioniert ein Potentiostat (kurz gesagt)?
Wie bereits erwähnt, steuert ein Potentiostat das Potential der Arbeitselektrode und misst den durch sie fließenden Strom.
Warum nicht einfach zwei Elektroden? Einer der Gründe ist, dass wir das Potential der Arbeitselektrode nicht gegen einen festen Punkt messen können, wenn wir nur zwei Elektroden haben.
Stellen Sie sich ein Zwei-Elektroden-System vor, das aus der bereits erwähnten Arbeitselektrode und der Elektrode besteht, deren Potential unser fester Bezugspunkt, die Referenzelektrode, sein soll.
Wir legen ein bestimmtes Potential zwischen diese Elektroden an und an der Arbeitselektrode findet eine elektrochemische Reaktion statt, aber da der Stromkreis geschlossen werden muss und Strom fließen muss, muss eine Reaktion stattfinden, die umgekehrt zur Reaktion an der Arbeitselektrode ist, dh wenn an der Arbeitselektrode eine Oxidation auftritt, muss an der Referenzelektrode eine Reduktion stattfinden.
Wenn ein Strom auf konstantem Potential fließt, muss eine elektrochemische Reaktion nach dem Faradayschen Gesetz ablaufen:
Gleichung 3.1 / Faradaysches Gesetz
Diese Gleichung besagt, dass die Ladung Q, die durch eine Elektrode fließt, proportional zur Menge n einer Spezies ist, die z Elektronen an der Elektrode aufgenommen oder abgegeben hat. F ist die Faraday-Konstante und repräsentiert die Ladung von 1 mol Elektronen. Der Strom I ist die Ladung Q pro Zeit t, die durch die Elektrode fließt:
Gleichung 3.2
Die Gleichungen 3.1 und 3.2a zeigt, dass der fließende Strom I über den Betrag n mit der an der Elektrode ablaufenden Reaktion verbunden ist:
Gleichung 3.3
Stellen Sie sich nun vor, dass der Strom an der Referenzelektrode fließt. An dieser Elektrode wird eine Speziesmenge von n umgesetzt. Diese Umwandlung führt zu einer Veränderung der Oberfläche bzw. der Konzentration der die Elektrode umgebenden Lösung. Die Nernst-Gleichung zeigt eine klare Korrelation zwischen dem Potential E einer Elektrode und ihrer Umgebung:

Gleichung 3.4/ Nernst-Gleichung
E0 ist das Standardpotential des Redoxpaares Red und Ox. R ist die Gaskonstante und T die Temperatur. Die Aktivität der oxidierten und reduzierten Form der Spezies aOx und aRed in der umgebenden Lösung ist nicht immer leicht vorherzusagen. Dies führt oft zu einer Vereinfachung der Gleichung:

Gleichung 3.5
Die beiden Aktivitätskoeffizienten fOx und fRed sind im resultierenden Potential E0′ enthalten, das als formales Potential bezeichnet wird. Da es umgebungsabhängige Parameter wie Temperatur- und Aktivitätskoeffizienten enthält, kann E0′ nicht aufgeführt werden, muss aber bei Bedarf für jedes Experiment ermittelt werden. Die meisten Experimente in der analytischen Chemie werden bei Raumtemperatur (295 K) durchgeführt. Dies ermöglicht eine weitere Vereinfachung. Aus Bequemlichkeit wird auch die ln in das Protokoll übertragen.
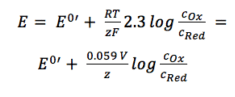
Gleichung 3.6
Für die praktische Anwendung ist Gleichung 3.6 die am häufigsten verwendete Form der Nernst-Gleichung. Für viele Anwendungen kann man davon ausgehen, dass E0 ungefähr gleich E0′ ist, da beide Aktivitätskoeffizienten nahe bei eins liegen.
In dieser Form (Gleichung 3.6) ist der Zusammenhang zwischen der Umgebung einer Elektrode und ihrem Potential besser sichtbar.
Wie bereits erwähnt, wurden alle Vereinfachungen bei Gleichung 3.4 durchgeführt: Die Änderung der die Referenzelektrode umgebenden Lösung aufgrund eines fließenden Stroms führt zu einer Änderung des Potentials, das unser fester Referenzpunkt sein soll. Wir können den Stromfluss durch die Referenzelektrode (RE) jedoch nicht begrenzen, da alle Einschränkungen durch den Prozess verursacht werden sollten, den wir untersuchen möchten, dh den Prozess an der Arbeitselektrode (WE).
Die Lösung für dieses Problem ist eine dritte Elektrode. An dieser Gegenelektrode (CE), auch Hilfselektrode genannt, findet die Gegenreaktion zu den Reaktionen der Arbeitselektrode statt. Der Strom fließt zwischen der Arbeits- und der Gegenelektrode. Das Potential wird zwischen Arbeits- und Bezugselektrode geregelt (siehe Abbildung 3.1).

Abbildung 3.1 / Ein schematisches Drei-Elektroden-System
Das Potential zwischen Gegen- und Referenzelektrode wird so eingestellt, dass der durch die Arbeitselektrode fließende Strom bei einem bestimmten Potential zwischen Arbeits- und Referenzelektrode erfüllt ist. Es gibt Grenzwerte für das Potential, das ein Potentiostat anlegen kann, zwischen RE und WE (DC-Potentialbereich) und CE und WE (Compliance-Spannung).
Da Sie das Potenzial zwischen RE und WE steuern, ist es einfach, innerhalb der Grenzen des DC-Potentialbereichs zu bleiben. Das CE muss größer sein als das WE, da die Konformitätsspannung vom Benutzer nicht kontrolliert werden kann. Eine größere Fläche bei gleichem Potential führt zu einem höheren Strom und das CE sollte genügend Strom liefern, ohne in die Compliance-Spannung zu laufen.
Eine Faustregel besagt, dass das CE 100 mal größer sein sollte als das WE. Für viele Experimente mag dies nicht notwendig sein, aber für eine gute Praxis sollten Sie sicherstellen, dass das CE groß genug ist, damit es den Stromfluss am WE nicht einschränkt.
Normalerweise ist der Abstand zwischen CE und WE groß genug, so dass sich die Reaktionen der beiden Elektroden nicht gegenseitig beeinflussen und die Gegenreaktion ignoriert werden kann, aber manchmal, zum Beispiel in kleinen Mengen, kann es hilfreich sein zu wissen, welche Reaktion an der Gegenelektrode stattfindet.