Colgando de la pared, los cuadrados parecen una pared dentada de bloques de alfabeto. Las letras no forman palabras. Las columnas son desiguales. Este gráfico, un icono de la química, se conoce como la Tabla Periódica de los Elementos. Dmitri Mendeleev( MEN-duh-LAY-ev), un científico ruso que trabaja en San Petersburgo, ideó una versión temprana. Eso fue hace 150 años. Sin embargo, incluso hoy en día, este gráfico ayuda a los científicos a entender los átomos y moléculas que componen nuestro universo.
Los elementos son los bloques de construcción de toda la materia. Sus átomos se entrelazan para formar literalmente todo: nosotros, el aire que respiramos, los organismos que comparten nuestro mundo y todas las demás moléculas de gas o pedacitos de masa que se encuentran en todo nuestro universo.
Las filas y columnas de la tabla periódica mapean la llamada ley periódica. Sostiene que los rasgos compartidos entre los elementos químicos se repiten en patrones regulares a medida que los elementos se hacen más grandes. Estos patrones vinculan elementos con comportamientos químicos similares y ayudan a indicar a los químicos cómo reaccionan los átomos para formar moléculas. La forma en que las filas y columnas de esta tabla se alinean apunta a rasgos compartidos entre grupos de elementos relacionados. Comprender esas relaciones ayuda a los químicos a crear nuevos compuestos. También les ayuda a entender cómo funciona la vida. Incluso les ayuda a predecir cómo se comportarán los nuevos materiales.

Pero la conocida carta de Mendeleev está lejos de ser la única tabla periódica. Los científicos han construido muchos, algunos con formas muy variadas. Los químicos diseñaron algunos. Científicos y profesores de otros campos desarrollaron otros.
«Las formas alternativas son útiles debido a los diferentes aspectos de la ciencia que ilustran», señala Carmen Giunta. Es químico en Le Moyne College en Syracuse, Nueva York.Esas tablas periódicas menos tradicionales proporcionan formas no solo de resaltar algunas de las peculiaridades de la química, dice, sino también de enfocarlas mejor.
Educadores y Padres, regístrese en La Hoja de trucos
Actualizaciones semanales para ayudarlo a usar Noticias Científicas para estudiantes en el entorno de aprendizaje
En 2019, el mundo celebra la tabla periódica en todas sus formas y cómo ayuda a organizar y dar sentido a los bloques de construcción de nuestro universo.
Es elemental
Justo después del Big Bang, el universo estaba compuesto solo de hidrógeno y helio, los dos elementos más ligeros. La gravedad unió a estos átomos en cantidades cada vez mayores. Con el tiempo, esto crearía hornos densos y ardientes que conocemos como estrellas. En el centro de estas estrellas, intensas presiones fusionaron núcleos atómicos — los centros de los átomos — creando núcleos más grandes.
Estos elementos forjados lentamente son más grandes y pesados. Incluían el carbono, un elemento esencial para toda la vida tal como la conocemos. Esas forjas estelares también formaron el oxígeno que necesitamos para respirar.
Hacer elementos más grandes que el hierro requería aún más potencia de fuego cósmica. Núcleos atómicos pesados se formaron cuando explotaron estrellas masivas moribundas. Estas supernovas golpearon con fuerza elementos más pequeños.
Para su tabla periódica de 1869, Mendeleev dispuso los elementos en orden de masa ascendente. Fue uno de los primeros científicos que se dio cuenta de que la química tiene patrones repetitivos. A medida que los elementos se hacen más grandes, algunas de sus propiedades eventualmente se repiten. Ciertos elementos prefieren reaccionar, volviéndose cargados positivamente. Algunos prefieren ser cargados negativamente. Tales patrones permitieron a los científicos anticipar si los diferentes tipos de elementos probablemente se combinarían o cómo.
En su revista de investigación, Mendeleev escribió que la idea de esta mesa se le ocurrió en un sueño. Empezó con una pelea. Pero a medida que se repitieron las propiedades químicas, comenzó una nueva fila. Alineó elementos con comportamientos similares en columnas. Dejó huecos. Esos agujeros, razonó, marcaban elementos que probablemente existían pero que aún no habían sido descubiertos.
Cuando publicó esa tabla, Mendeleev predijo las propiedades y masas de cuatro nuevos elementos. Finalmente, los cuatro fueron descubiertos tres en solo 10 años.
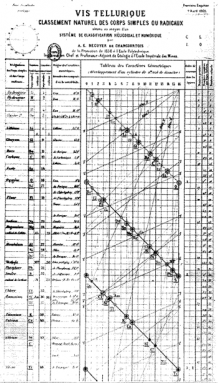
Alexandre-Émile Béguyer de Chancourtois fue un geólogo francés. Siete años antes de la famosa mesa de Mendeleev, creó una «mesa espiral».»Él arregló los elementos en orden de peso atómico. Mostraba los períodos repetidos. Sin embargo, no mostraba interrupciones entre las filas. En su lugar, enrolló su larga y delgada carta alrededor de un cilindro. De esta manera, cada fila fluía hacia la siguiente. Y elementos similares alineados uno encima del otro en columnas ordenadas.
Otros científicos elaboraron gráficos similares. En poco tiempo, los esfuerzos para organizar todos los elementos conocidos se multiplicaron. A medida que todos estos gráficos evolucionaron, uno llegó a dominar. Es la que se ve hoy en día en las aulas y los libros de texto de todo el mundo.
Cada uno de los 118 elementos conocidos tiene su propio símbolo químico: una o dos letras que representan orgullosamente el nombre del elemento de su caja en la tabla periódica. Algunas de estas abreviaturas son obvias, como H para hidrógeno o C para carbono. Otros se remontan a la antigüedad. Por ejemplo, el símbolo de sodio es Na. ¿Por qué? En latín, el nombre del sodio es natrium.
Cada caja de la mesa tiene un número entero, normalmente en la esquina superior izquierda. Llamado número atómico, enumera cuántos protones, o partículas cargadas positivamente, se empaquetan en el núcleo del elemento. Ese núcleo también incluye neutrones (partículas con masa pero sin carga). Alrededor del núcleo hay una nube de electrones mucho más pequeños con carga negativa.
El número inferior en el cuadrado del gráfico para cada elemento incluye dígitos después de un punto decimal. Este valor es la masa atómica del elemento. Representa la masa media de un átomo de ese elemento.
La tabla periódica es simple, potente y continúa produciendo nuevos experimentos, dice Eric Scerri. Es profesor de química en la Universidad de California, Los Ángeles. También escribe libros sobre la tabla periódica. Describe los principios organizativos detrás de la tabla periódica como » un descubrimiento absolutamente importante.»
Las torres dobles llegaron a dominar
La tabla periódica más común de hoy en día se conoce a veces como la versión de» torres gemelas». El hidrógeno (H) corona la torre alta de la izquierda. El helio (He) encabeza la torre derecha.

A medida que los átomos se hacen más grandes, se vuelven más complejos. En estos gráficos, un período dentro de la tabla periódica se refiere a una fila de elementos que exhiben algún ciclo repetitivo. Dentro de la tabla, el ancho de una fila, también llamado punto, se determina para que se mantenga el patrón de comportamiento de los elementos dentro de una columna. El patrón se repite primero en dos elementos, de modo que la fila tenga dos elementos de ancho. Luego, el patrón se repite en ocho elementos. Y a medida que los elementos se hacen más grandes, señala Scerri, «los períodos se hacen más y más largos», finalmente con 18 elementos y luego 32.
Los períodos más largos y grandes podrían hacer que la base de elementos pesados de esta mesa fuera torpemente ancha. Para evitar esto, la carta de torres gemelas generalmente saca parte de las dos filas inferiores. Coloca estos elementos en la parte inferior de la página, casi como notas al pie de página. Estas filas inferiores contienen grupos de elementos conocidos como lantánidos (LAN-tha-nydes) y actínidos (AK-tih-nydes).
Los actínidos incluyen los elementos más nuevos y más grandes. Muchos son radiactivos y no ocurren naturalmente. En cambio, los físicos los fabrican en laboratorios bombardeando elementos más pequeños entre sí. Estos elementos radioactivos y súper pesados también son súper inestables. Eso significa que se descomponen en elementos más pequeños en fracciones de segundo.
Cómo son útiles
Una tabla periódica puede servir como una especie de libro de recetas. El gráfico muestra cómo se relacionan los elementos entre sí. Por lo tanto, donde un elemento se sienta en la mesa le dice a un químico cómo puede interactuar o no con otros ingredientes. A menudo, estos rasgos útiles incluyen su masa, punto de ebullición y otros datos importantes.
La disposición de la mesa ayuda a los químicos a resolver problemas. Por ejemplo, los químicos podrían querer hacer un compuesto nuevo con rasgos similares a uno existente, simplemente mejor. Por lo tanto, podrían buscar un sustituto con características similares, comenzando con otro elemento de la misma columna en la tabla.
El verdadero regalo de estas mesas, dice Brigitte Van Tiggelen, es «tener toda la información en un solo lugar y enseñarla y compartirla.»Historiadora, trabaja como directora europea del Instituto de Historia de la Ciencia en Filadelfia, Pensilvania.
La carta de torre doble tiene muchas ventajas, dice Mark Leach. Es químico en Inglaterra en la Universidad Metropolitana de Manchester. Ninguna otra tabla logra mostrar los patrones repetitivos tan bien, argumenta, al mismo tiempo que incluye otras características.
Por ejemplo, todos los metales están en el lado izquierdo. Los no metales cuelgan a la derecha. Este gráfico también muestra cómo cambia el tamaño de un átomo y con qué facilidad es probable que entregue un electrón. Tales rasgos son importantes para entender cómo los átomos actuarán, reaccionarán y se casarán con otros para formar moléculas.

Pero la carta de las torres gemelas no es perfecta.
Los químicos a menudo discuten sobre dónde colocar el hidrógeno y el helio, por ejemplo. Y una mesa plana y bidimensional no muestra cómo se conectan las filas entre sí. Como llegar al final de una fila, Scerri, dice, «tienes la sensación de que se te caiga.»
Roy Alexander trabajó como constructor de exposiciones. No le gustaba la forma en que terminaban abruptamente las filas de la mesa de la torre gemela. Así que en 1965 cortó una tabla periódica tradicional en tiras. Luego los volvió a juntar, creando una versión en 3D.
Años más tarde, se enteró de que el físico George Gamow construyó una mesa casi idéntica en la década de 1940. Recuerda Alexander: «Era increíble lo idéntico que se veía a mi dibujo de patente.»
Teniendo en cuenta los períodos cada vez más grandes
Cuando Béguyer de Chancourtois creó por primera vez su tabla periódica, muchos de los elementos más grandes aún no habían sido descubiertos. A medida que los elementos se hacen más grandes, los rasgos compartidos se repiten con menos frecuencia. Finalmente, las filas más largas con los elementos de lantánido y actínido hicieron que la carta tradicional fuera torpemente ancha.
Una mesa 3D puede incorporar estas filas más largas simplemente haciendo que la espiral sea más ancha. El químico canadiense Fernando Dufour diseñó ElemenTree para ilustrar esto (ver foto). Hizo cada período como una capa hexagonal que contenía todos los elementos que generalmente aparecían en una sola fila en la carta de torres gemelas. Elementos similares todavía se alinean verticalmente.

Pero una mesa en forma de árbol no es la única respuesta en 3D. En la década de 1950, la profesora de química Jennie Clauson dependía de un cilindro para su mesa. Pero en lugar de sacar elementos extra, metió algunos de ellos hacia el centro.
Otro problema con la mesa de torre doble es dónde colocar hidrógeno y helio. El hidrógeno a veces actúa más como un metal, por ejemplo. Se desprenderá de su electrón y atraerá iones cargados negativamente. Otras veces actúa como un no metal y agarra un electrón extra y se carga negativamente. Luego actúa más como un flúor o cloro y esponja iones positivos.
Para explicar esto, el químico Theodor Benfey creó una mesa de espiral plana en la década de 1960 que puso hidrógeno y helio en medio de un gran círculo azul. Cada uno de los tres radios exteriores dentro del círculo representa un grupo de elementos similares. Para incluir los elementos más grandes y los ciclos periódicos de crecimiento, agregó terrazas que sobresalen del círculo. Incluyen los metales de transición, lantánidos y actínidos.
Una mesa plana como las torres gemelas es conveniente para colgar en una pared o imprimir en un libro. Sin embargo, Leach agrega: «Realmente no hay ninguna razón por la que la tabla periódica no sea tridimensional.»
Diversión y juegos?
Una de las últimas incorporaciones a la creciente biblioteca de tablas periódicas proviene de la Sociedad Química Europea, o ECS. Con sede en Bruselas, Bélgica, ECS pretende llamar la atención sobre la relativa escasez de muchos elementos importantes. Señala que 30 elementos intervienen en la fabricación de un teléfono celular típico. Y muchos de esos elementos no están ampliamente disponibles.
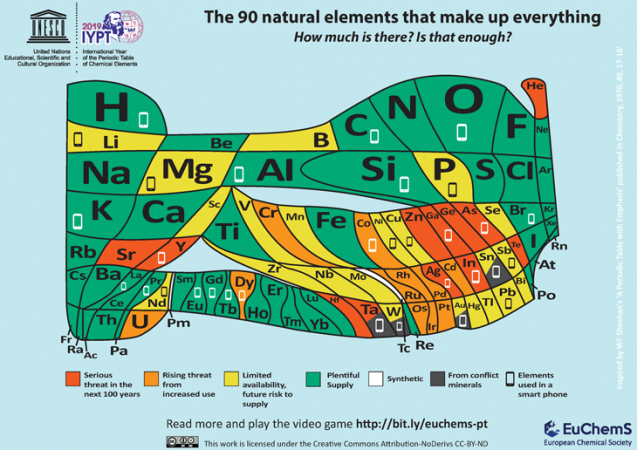
«es necesario observar cuidadosamente nuestras tendencias a desperdiciar y reciclar de manera inadecuada tales artículos», argumenta el ECS. «A menos que se proporcionen soluciones, corremos el riesgo de que se agoten muchos de los elementos naturales que componen el mundo que nos rodea, ya sea debido a la escasez de suministros, su ubicación en zonas de conflicto o nuestra incapacidad para reciclarlos por completo.»
El ECS reconoce que esta nueva tabla es » estimulante.»Y eso no es un accidente. Quiere que la gente entienda el valor de no desperdiciar «elementos en peligro de extinción».»Todo el mundo, dice, necesita «preguntarse si las actualizaciones de nuestros teléfonos y otros dispositivos electrónicos son realmente necesarias. Y cuando nuestros productos electrónicos mueren, dice: «necesitamos asegurarnos de reciclar para que los elementos relativamente escasos no terminen en vertederos o contaminen el medio ambiente».»
Para explorar cómo la gente usa los elementos, ECS ha desarrollado un videojuego gratuito en línea: Elementary Escapades.
Hay mucho espacio para más tablas periódicas nuevas, dice Leach en Manchester. De hecho, se ha convertido en un hobby coleccionar nuevos y publicarlos en línea. Siempre está en la búsqueda de los viejos, también. «Probablemente reciba uno nuevo cada semana», dice.
Scerri también ha hecho que los estudiantes desarrollen otros nuevos. «Cada uno», dice, » tiene alguna pequeña virtud propia.»