¿Cómo funciona un Potenciostato (en pocas palabras)?
Como se mencionó anteriormente, un potenciostato controla el potencial del electrodo de trabajo y mide la corriente que fluye a través de él.
¿Por qué no solo dos electrodos? Una de las razones es que no podemos medir el potencial del electrodo de trabajo contra un punto fijo cuando solo tenemos dos electrodos.
Imagine un sistema de dos electrodos que consiste en el electrodo de trabajo ya mencionado y el electrodo, cuyo potencial debe ser nuestro punto de referencia fijo, el electrodo de referencia.
Aplicamos un cierto potencial entre estos electrodos y se produce una reacción electroquímica en el electrodo de trabajo, pero como el circuito debe cerrarse y la corriente debe fluir, debe producirse una reacción inversa a la reacción en el electrodo de trabajo, es decir, si se produce oxidación en el electrodo de trabajo, debe producirse una reducción en el electrodo de referencia.
Si una corriente fluye a un potencial constante, debe producirse una reacción electroquímica de acuerdo con la ley de Faraday:
Ecuación 3.1 / Ley de Faraday
Esta ecuación dice que la carga Q que fluye a través de un electrodo es proporcional a la cantidad n de una especie que tomó o dio electrones z en el electrodo. F es la constante de Faraday y representa la carga de electrones de 1 mol. La corriente I es la carga Q por tiempo t que fluye a través del electrodo:
Ecuación 3.2
Las ecuaciones 3.1 y 3.2 la combinación muestra que la corriente I que fluye está conectada a la reacción que ocurre en el electrodo a través de la cantidad n:
Ecuación 3.3
Imagine ahora que la corriente fluye en el electrodo de referencia. En este electrodo se convierte la cantidad de n de una especie. Esta conversión conduce a un cambio de la superficie o de la concentración de la solución que rodea el electrodo. La ecuación de Nernst muestra una clara correlación entre el potencial E de un electrodo y su entorno:

Ecuación 3.4 / Ecuación de Nernst
E0 es el potencial estándar del par redox Rojo y Buey. R es la constante de gas y T la temperatura. La actividad de la forma oxidada y reducida de las especies aOx y aRed en la solución circundante no siempre es fácil de predecir. Esto a menudo conduce a una simplificación de la ecuación:

Ecuación 3.5
Los dos coeficientes de actividad fOx y fRed se incluyen en el potencial resultante E0′, que se denomina potencial formal. Dado que contiene parámetros que dependen del entorno, como los coeficientes de temperatura y actividad, E0′ no puede enumerarse, sino que debe determinarse para cada experimento, si es necesario. La mayoría de los experimentos en química analítica se realizan a temperatura ambiente (295 K). Esto hace posible otra simplificación. Por conveniencia también el ln se transferirá al registro.
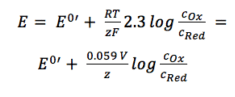
Ecuación 3.6
Para su aplicación práctica, la ecuación 3.6 es la forma más utilizada de la ecuación de Nernst. Para muchas aplicaciones se puede suponer que E0 es aproximadamente lo mismo que E0′, porque ambos coeficientes de actividad están cerca de uno.
En esta forma (ecuación 3.6) la correlación entre el entorno de un electrodo y su potencial es visible más fácilmente.
Como se mencionó anteriormente, se realizaron todas las simplificaciones en la ecuación 3.4: El cambio de la solución que rodea el electrodo de referencia, debido a una corriente que fluye, conduce a un cambio del potencial que se supone que es nuestro punto de referencia fijo. Pero no podemos limitar el flujo de corriente a través del electrodo de referencia (RE), porque todas las limitaciones deben ser causadas por el proceso que queremos investigar, es decir, el proceso en el electrodo de trabajo (WE).
La solución para este problema es un tercer electrodo. En este electrodo de contador (CE), también conocido como electrodo auxiliar, tiene lugar la contra-reacción a las reacciones del electrodo de trabajo. La corriente fluye entre el electrodo de trabajo y el contador. El potencial se controla entre el electrodo de trabajo y el de referencia (véase la Figura 3.1).

Figura 3.1 / A sistema esquemático de tres electrodos
El potencial entre el contador y el electrodo de referencia se ajusta de tal manera que se satisface la corriente que fluye a través del electrodo de trabajo a un cierto potencial entre el electrodo de trabajo y el electrodo de referencia. Hay límites para el potencial que un potenciostato puede aplicar entre RE y WE (rango de potencial de CC) y CE y WE (voltaje de cumplimiento).
Dado que usted controla el potencial entre RE y WE, es fácil mantenerse dentro de los límites del rango de potencial de CC. El CE tiene que ser más grande que el WE, porque el voltaje de cumplimiento no puede ser controlado por el usuario. Una superficie más grande con el mismo potencial conduce a una corriente más alta y el CE debe proporcionar suficiente corriente sin entrar en el voltaje de cumplimiento.
Una regla general sugiere que el CE debe ser 100 veces más grande que el WE. Para muchos experimentos, esto puede no ser necesario, pero para una buena práctica, debe asegurarse de que el CE sea lo suficientemente grande para que no limite la corriente que fluye en el WE.
Por lo general, la distancia entre CE y WE es lo suficientemente grande como para que las reacciones de los dos electrodos no se influyan entre sí, y la contra-reacción se puede ignorar, pero a veces, en volúmenes pequeños, por ejemplo, puede ser útil saber qué reacción ocurre en el contra-electrodo.