Détecteurs
Plusieurs types de détecteurs sont utilisés. Le détecteur à ionisation de flamme décrit ci-dessous est couramment utilisé et est plus facile à décrire et à expliquer que les alternatives.
Un détecteur d’ionisation de flamme
En termes de mécanismes réactionnels, la combustion d’un composé organique est très compliquée. Au cours du processus, de petites quantités d’ions et d’électrons sont produites dans la flamme. La présence de ceux-ci peut être détectée. L’ensemble du détecteur est enfermé dans son propre four qui est plus chaud que la température de la colonne. Cela empêche toute condensation dans le détecteur.
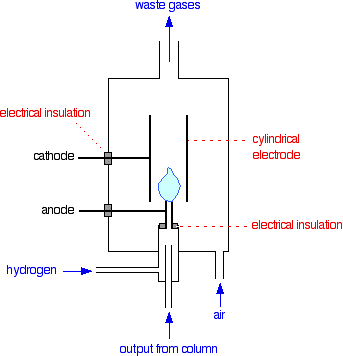
S’il n’y a rien d’organique qui sort de la colonne, vous avez juste une flamme d’hydrogène qui brûle dans l’air. Supposons maintenant que l’un des composés du mélange que vous analysez commence à passer.
En brûlant, il produira de petites quantités d’ions et d’électrons dans la flamme. Les ions positifs seront attirés par la cathode cylindrique. Les ions négatifs et les électrons seront attirés vers le jet lui-même qui est l’anode.
C’est à peu près la même chose que ce qui se passe pendant l’électrolyse normale.
À la cathode, les ions positifs vont capter les électrons de la cathode et être neutralisés. À l’anode, tous les électrons de la flamme seront transférés à l’électrode positive; et les ions négatifs donneront leurs électrons à l’électrode et seront neutralisés.
Cette perte d’électrons d’une électrode et ce gain à l’autre se traduiront par un flux d’électrons dans le circuit externe de l’anode à la cathode. En d’autres termes, vous obtenez un courant électrique.
Le courant ne sera pas très important, mais il peut être amplifié. Plus il y a de composé organique dans la flamme, plus il y aura d’ions produits, et donc plus le courant sera élevé. À titre d’approximation raisonnable, surtout si vous parlez de composés similaires, le courant que vous mesurez est proportionnel à la quantité de composé dans la flamme.
Inconvénients du détecteur à ionisation de flamme
Le principal inconvénient est qu’il détruit tout ce qui sort de la colonne lorsqu’il le détecte. Si vous vouliez envoyer le produit à un spectromètre de masse, par exemple, pour une analyse plus approfondie, vous ne pouviez pas utiliser de détecteur à ionisation de flamme.
Interprétation de la sortie du détecteur
La sortie sera enregistrée sous la forme d’une série de pics – chacun représentant un composé dans le mélange traversant le détecteur. Tant que vous avez pris soin de contrôler les conditions sur la colonne, vous pouvez utiliser les temps de rétention pour aider à identifier les composés présents – à condition, bien sûr, que vous (ou quelqu’un d’autre) les ayez déjà mesurés pour des échantillons purs des différents composés dans ces conditions identiques.
Mais vous pouvez également utiliser les pics comme moyen de mesurer les quantités relatives des composés présents. Ceci n’est exact que si vous analysez des mélanges de composés similaires – par exemple, des hydrocarbures similaires.
Les zones sous les pics sont proportionnelles à la quantité de chaque composé qui a passé le détecteur, et ces zones peuvent être calculées automatiquement par l’ordinateur relié à l’affichage. Les zones qu’il mesurerait sont indiquées en vert dans le diagramme (très simplifié).
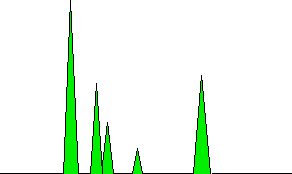
Notez que ce n’est pas la hauteur du pic qui compte, mais la surface totale sous le pic. Dans cet exemple particulier, le pic de gauche est à la fois le plus haut et a la plus grande surface. Ce n’est pas nécessairement toujours le cas. Il peut y avoir beaucoup d’un composé présent, mais il peut émerger de la colonne en quantités relativement faibles sur une période assez longue. La mesure de la surface plutôt que de la hauteur du pic permet cela.