Accrochés au mur, les carrés ressemblent à un mur déchiqueté de blocs d’alphabet. Les lettres ne forment pas de mots. Les colonnes sont inégales. Ce tableau — une icône de la chimie – est connu sous le nom de Tableau périodique des éléments. Dmitri Mendeleev (MEN-duh-LAY-ev), un scientifique russe travaillant à Saint-Pétersbourg, a proposé une première version. C’était il y a 150 ans. Pourtant, même aujourd’hui, ce graphique aide les scientifiques à comprendre les atomes et les molécules qui composent notre univers.
Les éléments sont les éléments constitutifs de toute matière. Leurs atomes se tricotent ensemble pour former littéralement tout – nous, l’air que nous respirons, les organismes qui partagent notre monde et toutes les autres molécules de gaz ou de masse présentes dans notre univers.
Les lignes et les colonnes du tableau périodique correspondent à la loi dite périodique. Il soutient que les traits communs entre les éléments chimiques se répètent dans des motifs réguliers à mesure que les éléments grossissent. Ces motifs relient des éléments à des comportements chimiques similaires et aident les chimistes à savoir comment les atomes réagissent pour former des molécules. La façon dont les lignes et les colonnes de cette table s’alignent indique des traits partagés entre des groupes d’éléments liés. Comprendre ces relations aide les chimistes à créer de nouveaux composés. Cela les aide également à comprendre comment fonctionne la vie. Cela les aide même à prédire le comportement des nouveaux matériaux.

Mais le tableau bien connu de Mendeleïev est loin d’être le seul tableau périodique. Les scientifiques en ont construit beaucoup, certains avec des formes très variables. Les chimistes en ont conçu. Les scientifiques et les enseignants dans d’autres domaines en ont développé d’autres.
« Les formes alternatives sont utiles en raison des différents aspects de la science qu’elles illustrent », note Carmen Giunta. Il est chimiste au collège Le Moyne à Syracuse, dans l’État de New York. Ces tableaux périodiques moins traditionnels fournissent des moyens non seulement de mettre en évidence certaines des bizarreries de la chimie, dit-il, mais aussi de les mettre davantage en évidence.
Éducateurs et Parents, Inscrivez-vous à la Feuille de triche
Mises à jour hebdomadaires pour vous aider à utiliser les Nouvelles scientifiques pour les élèves dans l’environnement d’apprentissage
En 2019, le monde célèbre le tableau périodique sous toutes ses formes et comment il aide à organiser et à donner un sens aux éléments constitutifs de notre univers.
C’est élémentaire
Juste après le Big Bang, l’univers n’était composé que d’hydrogène et d’hélium — les deux éléments les plus légers. La gravité a réuni ces atomes en quantités toujours plus grandes. Finalement, cela créerait des fours chauds denses et ardents que nous connaissons sous le nom d’étoiles. Au centre de ces étoiles, des pressions intenses ont fusionné des noyaux atomiques — les centres des atomes — créant des noyaux plus gros.
Cela forge lentement des éléments plus grands et plus lourds. Ils comprenaient le carbone, un élément essentiel à toute vie telle que nous la connaissons. Ces forges stellaires ont également formé l’oxygène dont nous avons besoin pour respirer.
Rendre les éléments plus grands que le fer nécessitait encore plus de puissance de feu cosmique. Des noyaux atomiques lourds se sont formés lorsque des étoiles massives et mourantes ont explosé. Ces supernovas ont claqué avec force des éléments plus petits ensemble.
Pour son tableau périodique de 1869, Mendeleïev a disposé les éléments par ordre de masse ascendante. Il a été l’un des premiers scientifiques à avoir réalisé que la chimie avait des motifs répétitifs. À mesure que les éléments s’agrandissent, certaines de leurs propriétés finissent par se répéter. Certains éléments préfèrent réagir, devenant chargés positivement. Certains préfèrent être chargés négativement. De tels modèles ont permis aux scientifiques d’anticiper si ou comment différents types d’éléments se combineraient probablement.
Dans son journal de recherche, Mendeleev a écrit que l’idée de cette table lui était venue dans un rêve. Il a commencé par une dispute. Mais comme les propriétés chimiques se répétaient, il a commencé une nouvelle rangée. Il a aligné des éléments avec des comportements similaires dans des colonnes. Il a laissé des lacunes. Ces trous, raisonna-t-il, marquaient des éléments qui existaient probablement mais n’avaient pas encore été découverts.
Lorsqu’il a publié ce tableau, Mendeleïev a prédit les propriétés et les masses de quatre nouveaux éléments. Finalement, les quatre ont été découverts – trois en seulement 10 ans.
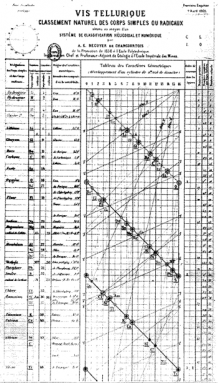
Alexandre-Émile Béguyer de Chancourtois est un géologue français. Sept ans avant la célèbre table de Mendeleïev, il a créé une « table en spirale ». »Il a disposé les éléments par ordre de poids atomique. Il a montré les périodes de répétition. Il n’a cependant pas montré de pauses entre les rangées. Au lieu de cela, il enroula sa longue et mince carte autour d’un cylindre. De cette façon, chaque ligne s’est écoulée dans la suivante. Et des éléments similaires alignés les uns au-dessus des autres dans des colonnes soignées.
D’autres scientifiques ont élaboré des cartes similaires. Rapidement, les efforts pour organiser tous les éléments connus ont fait boule de neige. Au fur et à mesure que tous ces graphiques évoluaient, on est devenu dominant. C’est celui que l’on voit aujourd’hui dans les salles de classe et les manuels scolaires du monde entier.
Chacun des 118 éléments connus a son propre symbole chimique — une ou deux lettres qui représentent fièrement le nom de l’élément dans sa boîte du tableau périodique. Certaines de ces abréviations sont évidentes, comme H pour l’hydrogène ou C pour le carbone. D’autres remontent à l’Antiquité. Par exemple, le symbole du sodium est Na. Pourquoi? En latin, le nom de sodium est natrium.
Chaque boîte sur la table a un nombre entier, généralement dans son coin supérieur gauche. Appelé numéro atomique, il répertorie le nombre de protons, ou particules chargées positivement, qui sont emballés dans le noyau de l’élément. Ce noyau comprend également des neutrons (particules de masse mais sans charge). Autour du noyau se trouve un nuage d’électrons beaucoup plus petits et chargés négativement.
Le numéro du bas du carré du graphique pour chaque élément comprend des chiffres après une virgule décimale. Cette valeur est la masse atomique de l’élément. Il représente la masse moyenne d’un atome de cet élément.
Le tableau périodique est simple, puissant et continue de donner lieu à de nouvelles expériences, explique Eric Scerri. Il enseigne la chimie à l’Université de Californie à Los Angeles. Il écrit également des livres sur le tableau périodique. Il décrit les principes d’organisation derrière le tableau périodique comme « une découverte absolument majeure. »
Les tours doubles ont dominé
Le tableau périodique le plus courant d’aujourd’hui est parfois connu sous le nom de version « tours jumelles ». L’hydrogène (H) couronne la haute tour à gauche. L’hélium (He) domine la tour de droite.

À mesure que les atomes grossissent, ils deviennent plus complexes. Dans ces graphiques, une période du tableau périodique fait référence à une rangée d’éléments présentant un cycle répétitif. Dans le tableau, la largeur d’une ligne — également appelée période — est déterminée de sorte que le modèle du comportement des éléments dans une colonne soit maintenu. Le motif se répète d’abord en deux éléments, de sorte que la rangée a deux éléments de large. Ensuite, le motif se répète en huit éléments. Et à mesure que les éléments grossissent, note Scerri, « les périodes s’allongent de plus en plus » – finalement avec 18 éléments, puis 32.
Les périodes plus longues et plus longues pourraient élargir maladroitement la base des éléments lourds de cette table. Pour contourner ce problème, le graphique des tours jumelles retire généralement une partie des deux rangées inférieures. Il place ces éléments au bas de la page, presque comme des notes de bas de page. Ces rangées inférieures contiennent des groupes d’éléments connus sous le nom de lanthanides (LAN-tha-nydes) et d’actinides (AK-tih-nydes).
Les actinides comprennent les éléments les plus récents et les plus volumineux. Beaucoup sont radioactifs et ne se produisent pas naturellement. Les physiciens les fabriquent plutôt dans des laboratoires en bombardant des éléments plus petits les uns dans les autres. Ces éléments radioactifs et super lourds sont également super instables. Cela signifie qu’ils se désagrègent en éléments plus petits en quelques fractions de seconde.
Comment ils sont utiles
Un tableau périodique peut servir de livre de recettes. Le graphique montre comment les éléments se rapportent les uns aux autres. Ainsi, lorsqu’un élément est assis sur la table, il indique à un chimiste comment il peut interagir ou non avec d’autres ingrédients. Souvent, ces traits utiles incluent sa masse, son point d’ébullition et d’autres données importantes.
La disposition de la table aide les chimistes à résoudre les problèmes. Par exemple, les chimistes pourraient vouloir créer un nouveau composé avec des caractéristiques similaires à celles d’un composé existant — tout simplement mieux. Ils pourraient donc chercher un substitut avec des fonctionnalités similaires, en commençant par un autre élément de la même colonne sur la table.
Le vrai cadeau de ces tables, dit Brigitte Van Tiggelen, est » d’avoir toutes les informations au même endroit, de les enseigner et de les partager. » Historienne, elle travaille comme directrice européenne de l’Institut d’histoire des sciences de Philadelphie, en Pennsylvanie.
La carte des tours jumelles présente de nombreux avantages, explique Mark Leach. Il est chimiste en Angleterre à l’Université métropolitaine de Manchester. Aucun autre tableau ne parvient à montrer si bien les motifs répétitifs, soutient-il, tout en incluant d’autres caractéristiques.
Par exemple, tous les métaux sont sur le côté gauche. Les non-métaux traînent à droite. Ce graphique montre également comment la taille d’un atome change et avec quelle facilité il abandonnera probablement un électron. De tels traits sont importants pour comprendre comment les atomes vont agir, réagir et se marier avec les autres pour former des molécules.

Mais le tableau des tours jumelles n’est pas parfait.
Les chimistes se disputent souvent pour savoir où placer l’hydrogène et l’hélium, par exemple. Et un tableau plat en deux dimensions ne montre pas vraiment comment les lignes se connectent les unes aux autres. Alors que vous arrivez à la fin d’une rangée, Scerri dit: « Vous avez l’impression de tomber en quelque sorte. »
Roy Alexander a travaillé comme constructeur d’expositions. Il n’aimait pas la façon dont les rangées de la table de la tour jumelle se terminaient brusquement. Ainsi, en 1965, il a découpé un tableau périodique traditionnel en bandes. Puis il les a remis ensemble, créant une version 3D.
Des années plus tard, il apprend que le physicien George Gamow a construit une table presque identique dans les années 1940. Se souvient Alexander, « C’était incroyable à quel point cela ressemblait à mon dessin de brevet. »
Compte tenu des périodes de plus en plus importantes
Lorsque Béguyer de Chancourtois a créé son tableau périodique pour la première fois, beaucoup des éléments les plus importants n’avaient pas encore été découverts. À mesure que les éléments s’agrandissent, les traits partagés se répètent moins fréquemment. Finalement, les rangées plus longues avec les éléments lanthanide et actinide ont rendu le tableau traditionnel maladroitement large.
Une table 3D peut incorporer ces rangées plus longues en élargissant simplement la spirale. Le chimiste canadien Fernando Dufour a conçu ElemenTree pour illustrer cela (voir photo). Il a fait de chaque période une couche hexagonale qui contenait tous les éléments qui apparaissaient généralement sur une seule rangée sur le graphique à deux tours. Des éléments similaires s’alignent toujours verticalement.

Mais une table en forme d’arbre n’est pas la seule réponse en 3D. Dans les années 1950, la professeure de chimie Jennie Clauson s’est appuyée sur un cylindre pour sa table. Mais au lieu de bomber des éléments supplémentaires, elle en a caché certains vers le centre.
Un autre problème avec la table à deux tours est de savoir où placer l’hydrogène et l’hélium. L’hydrogène agit parfois plus comme un métal, par exemple. Il perdra son électron et attirera des ions chargés négativement. D’autres fois, il agit comme un non-métal et attrape un électron supplémentaire et se charge négativement. Ensuite, il agit plus comme un fluor ou du chlore et éponge les ions positifs.
Pour tenir compte de cela, le chimiste Theodor Benfey a créé une table en spirale plate dans les années 1960. Elle mettait de l’hydrogène et de l’hélium au milieu d’un grand cercle bleu. Chacun des trois rayons extérieurs dans le cercle représente un groupe d’éléments similaires. Pour inclure les éléments plus grands et les cycles périodiques croissants, il a ajouté des terrasses qui dépassent du cercle. Ils comprennent les métaux de transition, les lanthanides et les actinides.
Une table plate comme les tours jumelles est pratique pour être accrochée au mur ou pour imprimer dans un livre. Cependant, ajoute Leach, « Il n’y a vraiment aucune raison pour que le tableau périodique ne soit pas tridimensionnel. »
Du plaisir et des jeux ?
L’un des derniers ajouts à la bibliothèque croissante de tableaux périodiques provient de l’European Chemical Society, ou ECS. Basée à Bruxelles, en Belgique, ECS vise à attirer l’attention sur la relative rareté de nombreux éléments importants. Il note que 30 éléments entrent dans la fabrication d’un téléphone portable typique. Et beaucoup de ces éléments ne sont pas largement disponibles.
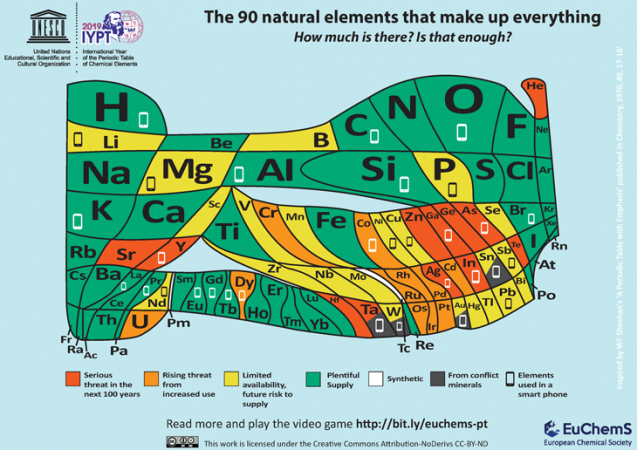
» nous devons examiner attentivement nos tendances à gaspiller et à recycler incorrectement ces articles « , soutient l’ECS. « Si des solutions ne sont pas apportées, nous risquons de voir de nombreux éléments naturels qui composent le monde qui nous entoure s’épuiser — que ce soit à cause des réserves limitées, de leur emplacement dans des zones de conflit ou de notre incapacité à les recycler complètement. »
L’ECS reconnaît que ce nouveau tableau » suscite la réflexion. » Et ce n’est pas un hasard. Il veut que les gens comprennent la valeur de ne pas gaspiller « les éléments en danger. »Tout le monde, dit-il, doit « se demander si des mises à niveau de nos téléphones et autres appareils électroniques sont vraiment nécessaires. »Et lorsque nos appareils électroniques meurent, dit-il, « nous devons nous assurer que nous recyclons » afin que des éléments relativement rares « ne se retrouvent pas dans les sites d’enfouissement ou ne polluent pas l’environnement. »
Pour explorer la façon dont les gens utilisent les éléments, l’ECS a développé un jeu vidéo en ligne gratuit: Elementary Escapades.
Il y a beaucoup de place pour d’autres nouveaux tableaux périodiques, dit Leach à Manchester. En fait, il s’est fait un passe-temps en collectant de nouveaux et en les publiant en ligne. Il est toujours à la recherche d’anciens, aussi. « J’en reçois probablement un nouveau chaque semaine », dit-il.
Les élèves de Scerri en ont aussi développé de nouveaux. » Chacun, dit-il, a une petite vertu qui lui est propre. »