Comment fonctionne un Potentiostat (en un mot)?
Comme mentionné précédemment, un potentiostat contrôle le potentiel de l’électrode de travail et mesure le courant qui la traverse.
Pourquoi pas seulement deux électrodes ? L’une des raisons est que nous ne pouvons pas mesurer le potentiel de l’électrode de travail par rapport à un point fixe lorsque nous n’avons que deux électrodes.
Imaginez un système à deux électrodes composé de l’électrode de travail déjà mentionnée et de l’électrode, dont le potentiel devrait être notre point de référence fixe, l’électrode de référence.
On applique un certain potentiel entre ces électrodes et une réaction électrochimique se produit au niveau de l’électrode de travail, mais comme le circuit doit être fermé et que le courant doit circuler, une réaction inverse à la réaction au niveau de l’électrode de travail doit se produire, c’est-à-dire que si une oxydation se produit au niveau de l’électrode de travail, une réduction doit avoir lieu au niveau de l’électrode de référence.
Si un courant circule à potentiel constant, une réaction électrochimique doit se produire selon la loi de Faraday:
Équation 3.1 / Loi de Faraday
Cette équation dit que la charge Q traversant une électrode est proportionnelle à la quantité n d’une espèce qui a pris ou donné des électrons z à l’électrode. F est la constante de Faraday et représente la charge des électrons de 1 mole. Le courant I est la charge Q par temps t traversant l’électrode:
Équation 3.2
Les équations 3.1 et 3.la combinaison 2 montre que le courant I circulant est relié à la réaction se produisant au niveau de l’électrode par l’intermédiaire de la quantité n:
Équation 3.3
Imaginez maintenant que le courant circule à l’électrode de référence. À cette électrode, une quantité d’espèce de n est convertie. Cette conversion entraîne une modification de la surface ou de la concentration de la solution entourant l’électrode. L’équation de Nernst montre une corrélation claire entre le potentiel E d’une électrode et son environnement:

Équation 3.4/ L’équation de Nernst
E0 est le potentiel standard du couple redox Red et Ox. R est la constante du gaz et T la température. L’activité de la forme oxydée et réduite des espèces aOx et aRed dans la solution environnante n’est pas toujours facile à prévoir. Cela conduit souvent à une simplification de l’équation:

Équation 3.5
Les deux coefficients d’activité fOx et fRed sont inclus dans le potentiel résultant E0′, appelé potentiel formel. Comme il contient des paramètres qui dépendent de l’environnement, tels que les coefficients de température et d’activité, E0 ‘ ne peut pas être répertorié mais doit être déterminé pour chaque expérience, si nécessaire. La plupart des expériences en chimie analytique sont réalisées à température ambiante (295 K). Cela permet une autre simplification. Par commodité, le ln sera également transféré dans le journal.
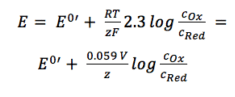
Équation 3.6
Pour une application pratique, l’équation 3.6 est la forme la plus utilisée de l’équation de Nernst. Pour de nombreuses applications, on peut supposer que E0 est à peu près le même que E0′, car les deux coefficients d’activité sont proches d’un.
Sous cette forme (équation 3.6), la corrélation entre l’entourage d’une électrode et son potentiel est plus facilement visible.
Comme mentionné précédemment, toutes les simplifications à l’équation 3.4 ont été effectuées : Le changement de la solution entourant l’électrode de référence, dû à un courant circulant, conduit à un changement du potentiel censé être notre point de référence fixe. Mais nous ne pouvons pas limiter le flux de courant à travers l’électrode de référence (RE), car toutes les limitations doivent être causées par le processus que nous voulons étudier, c’est-à-dire le processus à l’électrode de travail (WE).
La solution à ce problème est une troisième électrode. Au niveau de cette contre-électrode (CE), également appelée électrode auxiliaire, la contre-réaction aux réactions de l’électrode de travail a lieu. Le courant circule entre le travail et la contre-électrode. Le potentiel est contrôlé entre l’électrode de travail et l’électrode de référence (voir Figure 3.1).

Figure 3.1 / Un système schématique à trois électrodes
Le potentiel entre le compteur et l’électrode de référence est ajusté de manière à ce que le courant traversant l’électrode de travail à un certain potentiel entre l’électrode de travail et l’électrode de référence soit satisfait. Il existe des limites pour le potentiel qu’un potentiostat peut appliquer entre RE et WE (plage de potentiel CONTINU) et CE et WE (tension de conformité).
Puisque vous contrôlez le potentiel entre RE et WE, il est facile de rester dans les limites de la plage de potentiel CC. Le CE doit être plus grand que le WE, car la tension de conformité ne peut pas être contrôlée par l’utilisateur. Une surface plus grande au même potentiel conduit à un courant plus élevé et le CE devrait fournir suffisamment de courant sans entrer dans la tension de conformité.
Une règle empirique suggère que le CE devrait être 100 fois plus grand que le WE. Pour de nombreuses expériences, cela peut ne pas être nécessaire, mais pour une bonne pratique, vous devez vous assurer que le CE est suffisamment grand pour qu’il ne limite pas le courant circulant au WE.
Habituellement, la distance entre CE et WE est suffisamment grande pour que les réactions des deux électrodes ne s’influencent pas l’une l’autre, et la contre-réaction peut être ignorée, mais parfois, dans de petits volumes par exemple, il peut être utile de savoir quelle réaction se produit à la contre-électrode.