Appesi al muro, i quadrati sembrano un muro frastagliato di blocchi di alfabeto. Le lettere non formano parole. Le colonne sono irregolari. Questo grafico-un’icona della chimica-è noto come la Tavola periodica degli elementi. Dmitri Mendeleev (MEN-duh-LAY-ev), uno scienziato russo che lavora a San Pietroburgo, ha inventato una prima versione. E ‘ stato 150 anni fa. Eppure ancora oggi, questo grafico aiuta gli scienziati a dare un senso agli atomi e alle molecole che compongono il nostro universo.
Gli elementi sono gli elementi costitutivi di tutta la materia. I loro atomi si uniscono per formare letteralmente tutto: noi, l’aria che respiriamo, gli organismi che condividono il nostro mondo e ogni altra molecola di gas o pezzo di massa che si trova in tutto il nostro universo.
Le righe e le colonne della tavola periodica mappano la cosiddetta legge periodica. Sostiene che i tratti condivisi tra gli elementi chimici si ripetono in schemi regolari man mano che gli elementi diventano più grandi. Questi modelli collegano elementi con comportamenti chimici simili e aiutano a dire ai chimici come reagiscono gli atomi per formare molecole. Il modo in cui le righe e le colonne di questa tabella si allineano punta a tratti condivisi tra gruppi di elementi correlati. Comprendere queste relazioni aiuta i chimici a creare nuovi composti. Li aiuta anche a capire come funziona la vita. Li aiuta anche a prevedere come si comporteranno i nuovi materiali.

Ma il noto grafico di Mendeleev è lontano dall’unica tavola periodica. Gli scienziati ne hanno costruiti molti, alcuni con forme molto diverse. I chimici hanno progettato alcuni. Scienziati e insegnanti in altri campi hanno sviluppato altri.
“Le forme alternative sono utili per i diversi aspetti della scienza che illustrano”, osserva Carmen Giunta. È un chimico al Le Moyne College di Syracuse, New York Quelle tavole periodiche meno tradizionali forniscono modi non solo per evidenziare alcune delle stranezze della chimica, dice, ma anche per metterle a fuoco meglio.
Educatori e Genitori, Firmare in su per Il Foglio di riepilogo
aggiornamenti Settimanali per aiutarvi a utilizzare le Notizie scientifiche per Studenti di ambiente di apprendimento
Nel 2019, il mondo festeggia la tavola periodica in tutte le sue forme e come aiuta a organizzare e dare un senso di blocchi di costruzione del nostro universo.
È elementare
Subito dopo il Big Bang, l’universo era composto solo da idrogeno ed elio — i due elementi più leggeri. La gravità ha riunito questi atomi in quantità sempre maggiori. Alla fine questo creerebbe forni caldi densi e infuocati che conosciamo come stelle. Al centro di queste stelle, pressioni intense fusero nuclei atomici-i centri degli atomi-creando nuclei più grandi.
Questo lentamente forgiato elementi più grandi e più pesanti. Includevano il carbonio, un elemento essenziale per tutta la vita come la conosciamo. Quelle fucine stellari hanno anche formato l’ossigeno di cui abbiamo bisogno per respirare.
Rendere gli elementi più grandi del ferro richiedeva ancora più potenza di fuoco cosmica. Nuclei atomici pesanti formati come stelle massicce e morenti esplose. Queste supernove hanno sbattuto con forza elementi più piccoli insieme.
Per la sua tavola periodica del 1869, Mendeleev dispose gli elementi in ordine di massa ascendente. Fu uno dei primi scienziati che si resero conto che la chimica ha schemi ripetuti. Man mano che gli elementi diventano più grandi, alcune delle loro proprietà alla fine si ripetono. Alcuni elementi preferiscono reagire, diventando caricati positivamente. Alcuni preferiscono essere caricati negativamente. Tali modelli hanno permesso agli scienziati di anticipare se o come diversi tipi di elementi sarebbero probabilmente combinati.
Nel suo diario di ricerca, Mendeleev ha scritto che l’idea di questo tavolo gli è venuta in un sogno. Ha iniziato con una riga. Ma come le proprietà chimiche ripetute, ha iniziato una nuova fila. Ha allineato elementi con comportamenti simili in colonne. Ha lasciato dei vuoti. Quei buchi, ragionò, segnavano elementi che probabilmente esistevano ma non erano ancora stati scoperti.
Quando pubblicò quella tabella, Mendeleev predisse le proprietà e le masse di quattro nuovi elementi. Alla fine tutti e quattro sono stati scoperti — tre in soli 10 anni.
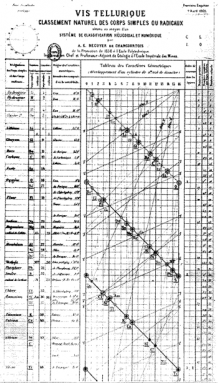
Alexandre-Émile Béguyer de Chancourtois è stato un geologo francese. Sette anni prima del famoso tavolo di Mendeleev, ha creato un “tavolo a spirale”.”Ha organizzato gli elementi in ordine di peso atomico. Ha mostrato i periodi ripetuti. Tuttavia, non ha mostrato interruzioni tra le righe. Invece, ha avvolto il suo lungo, sottile grafico intorno a un cilindro. In questo modo, ogni riga scorreva nella successiva. E elementi simili allineati l’uno sopra l’altro in colonne ordinate.
Altri scienziati hanno realizzato grafici simili. In poco tempo, gli sforzi per organizzare tutti gli elementi noti sono stati spazzati via. Come tutti questi grafici si sono evoluti, uno è salito a dominare. È quello visto oggi in tutte le aule e libri di testo in tutto il mondo.
Ciascuno dei 118 elementi noti ha il proprio simbolo chimico — una o due lettere che rappresentano orgogliosamente il nome dell’elemento dalla sua casella sulla tavola periodica. Alcune di queste abbreviazioni sono ovvie, come H per idrogeno o C per carbonio. Altri risalgono ai tempi antichi. Ad esempio, il simbolo di sodio è Na. Perché? In latino, il nome di sodio è natrium.
Ogni casella sul tavolo ha un numero intero, in genere nell’angolo in alto a sinistra. Chiamato numero atomico, elenca quanti protoni, o particelle cariche positivamente, sono imballati nel nucleo dell’elemento. Quel nucleo include anche neutroni (particelle con massa ma senza carica). Intorno al nucleo c’è una nuvola di elettroni molto più piccoli e caricati negativamente.
Il numero inferiore nel quadrato del grafico per ogni elemento include cifre dopo un punto decimale. Questo valore è la massa atomica dell’elemento. Rappresenta la massa media di un atomo di quell’elemento.
La tavola periodica è semplice, potente e continua a produrre nuovi esperimenti, afferma Eric Scerri. Insegna chimica all’Università della California, Los Angeles. Scrive anche libri sulla tavola periodica. Egli descrive i principi organizzativi alla base della tavola periodica come ” una scoperta assolutamente importante.”
Le torri doppie arrivarono a dominare
La tavola periodica più comune di oggi è talvolta conosciuta come la versione” torri gemelle”. Idrogeno (H) corona l’alta torre a sinistra. Elio (Lui) supera la torre destra.

Man mano che gli atomi diventano più grandi, diventano più complessi. In questi grafici, un periodo all’interno della tavola periodica si riferisce a una fila di elementi che presentano un ciclo ripetuto. All’interno della tabella, la larghezza di una riga, chiamata anche punto, viene determinata in modo da mantenere il modello del comportamento degli elementi all’interno di una colonna. Il modello si ripete prima in due elementi, in modo che la riga sia larga due elementi. Quindi il modello si ripete in otto elementi. E man mano che gli elementi diventano più grandi, osserva Scerri, “i periodi si allungano sempre di più” — alla fine con 18 elementi, e poi 32.
I periodi più lunghi e più grandi potrebbero rendere goffamente ampia la base degli elementi pesanti di questa tabella. Per aggirare questo, il grafico a torre gemella di solito estrae parte delle due file inferiori. Posiziona questi elementi nella parte inferiore della pagina, quasi come note a piè di pagina. Queste righe inferiori contengono gruppi di elementi noti come lantanidi (LAN-tha-nydes) e attinidi (AK-tih-nydes).
Gli attinidi includono gli elementi più nuovi e più grandi. Molti sono radioattivi e non si verificano naturalmente. I fisici invece li fanno nei laboratori bombardando elementi più piccoli l’uno nell’altro. Questi elementi radioattivi e super-pesanti sono anche super instabili. Ciò significa che cadono a pezzi in elementi più piccoli entro frazioni di secondo.
Come sono utili
Una tavola periodica può servire come una sorta di ricettario. Il grafico mostra come gli elementi si relazionano tra loro. Quindi, dove un elemento si trova sul tavolo dice a un chimico come può o non può interagire con altri ingredienti. Spesso, questi tratti utili includono la sua massa, il punto di ebollizione e altri dati importanti.
La disposizione del tavolo aiuta i chimici a risolvere i problemi. Ad esempio, i chimici potrebbero voler creare un nuovo composto con tratti simili a uno esistente — solo meglio. Quindi potrebbero cercare un sostituto con caratteristiche simili, iniziando con un altro elemento dalla stessa colonna sul tavolo.
Il vero dono di queste tavole, dice Brigitte Van Tiggelen, è ” avere tutte le informazioni in un unico luogo e insegnarle e condividerle.”Una storica, lavora come direttore europeo per il Science History Institute di Philadelphia, Pa.
Il grafico twin tower ha molti vantaggi, afferma Mark Leach. È un chimico in Inghilterra alla Manchester Metropolitan University. Nessun altro tavolo riesce a mostrare i modelli ripetuti così bene, sostiene, per tutto il tempo comprese altre caratteristiche.
Ad esempio, tutti i metalli sono sul lato sinistro. Non metalli appendere fuori sulla destra. Questo grafico mostra anche come cambia la dimensione di un atomo e quanto facilmente probabilmente rinuncerà a un elettrone. Tali tratti sono importanti per capire come gli atomi agiranno, reagiranno e si sposeranno con gli altri per formare molecole.

Ma il grafico delle torri gemelle non è perfetto.
I chimici spesso discutono su dove posizionare idrogeno ed elio, per esempio. E una tabella piatta e bidimensionale non mostra davvero come le righe si connettono tra loro. Come si arriva alla fine di una riga, Scerri dice, “Si ha la sensazione che tipo di cadere.”
Roy Alexander ha lavorato come costruttore di mostre. Non gli piaceva il modo in cui le file del tavolo della torre gemella finivano bruscamente. Così nel 1965 ha tagliato un tradizionale grafico a tavola periodica in strisce. Poi li ha rimessi insieme, creando una versione 3-D.
Anni dopo, apprese che il fisico George Gamow costruì una tabella quasi identica negli anni ‘ 40. Alexander ricorda: “Era incredibile quanto fosse identico al mio disegno di brevetto.”
Considerando i periodi sempre più grandi
Quando Béguyer de Chancourtois creò per la prima volta la sua tavola periodica, molti degli elementi più grandi non erano ancora stati scoperti. Man mano che gli elementi diventano più grandi, i tratti condivisi si ripetono meno frequentemente. Alla fine, le file più lunghe con gli elementi lantanidi e attinidi hanno reso il grafico tradizionale goffamente ampio.
Una tabella 3D può incorporare queste file più lunghe semplicemente allargando la spirale. Il chimico canadese Fernando Dufour ha progettato ElemenTree per illustrare questo (vedi foto). Ha fatto ogni periodo come uno strato esagonale che conteneva tutti gli elementi che di solito appaiono in una singola riga sul grafico a doppia torre. Elementi simili si allineano ancora verticalmente.

Ma un tavolo a forma di albero non è l’unica risposta 3-D. Nel 1950, insegnante di chimica Jennie Clauson invocato un cilindro per il suo tavolo. Ma invece di sporgere elementi extra fuori, ha nascosto alcuni di loro verso il centro.
Un altro problema con la tabella twin tower è dove mettere idrogeno ed elio. L’idrogeno a volte agisce più come un metallo, per esempio. Libererà il suo elettrone e attirerà ioni caricati negativamente. Altre volte agisce come un metalloide e afferra un elettrone in più e si carica negativamente. Quindi agisce più come un fluoro o cloro e spugne fino ioni positivi.
Per tenere conto di questo, il chimico Theodor Benfey ha creato un tavolo a spirale piatta negli anni ‘ 60. Ha messo idrogeno ed elio nel mezzo di un grande cerchio blu. Ciascuno dei tre raggi esterni all’interno del cerchio rappresenta un gruppo di elementi simili. Per includere gli elementi più grandi e i cicli periodici in crescita, ha aggiunto terrazze che si gonfiano fuori dal cerchio. Includono i metalli di transizione, i lantanidi e gli attinidi.
Un tavolo piatto come le torri gemelle è conveniente per appendere su una parete o la stampa in un libro. Tuttavia, aggiunge Leach, ” Non c’è davvero alcun motivo per cui la tavola periodica non sia tridimensionale.”
Divertimento e giochi?
Una delle ultime aggiunte alla crescente libreria di tavole periodiche proviene dalla European Chemical Society, o ECS. Con sede a Bruxelles, in Belgio, ECS mira a portare l’attenzione sulla relativa scarsità di molti elementi importanti. Si osserva che 30 elementi vanno a fare un tipico telefono cellulare. E molti di questi elementi non sono ampiamente disponibili.
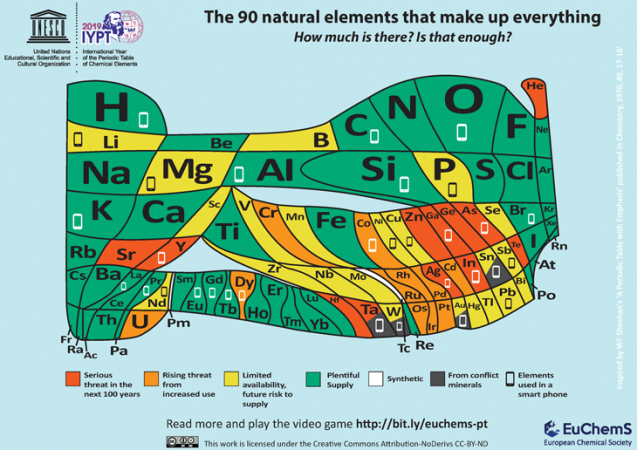
“e’ necessario esaminare attentamente le nostre tendenze a sprecare e riciclare in modo improprio tali articoli”, sostiene l’ECS. “A meno che non vengano fornite soluzioni, rischiamo di vedere molti degli elementi naturali che compongono il mondo che ci circonda esaurirsi, sia a causa delle forniture limitate, della loro posizione in aree di conflitto o della nostra incapacità di riciclarli completamente.”
L’ECS riconosce che questa nuova tabella è “stimolante.”E non è un caso. Vuole che la gente a capire il valore di non sprecare ” elementi in via di estinzione.”Tutti, dice, hanno bisogno” di chiedersi se gli aggiornamenti ai nostri telefoni e altri dispositivi elettronici siano veramente necessari.”E quando la nostra elettronica muore, dice,” dobbiamo assicurarci di riciclare “in modo che gli elementi relativamente scarsi” non finiscano nelle discariche o inquinano l’ambiente.”
Per esplorare come le persone usano gli elementi, l’ECS ha sviluppato un videogioco online gratuito: Escapades elementari.
C’è molto spazio per altre nuove tavole periodiche, dice Leach a Manchester. Infatti, ha fatto un hobby di raccolta di nuovi e la pubblicazione on-line. E ‘ sempre alla ricerca di quelli vecchi, pure. “Probabilmente ne ricevo uno nuovo ogni settimana”, dice.
Scerri ha fatto sviluppare anche nuovi studenti. “Ognuno”, dice, ” ha qualche piccola virtù propria.”