Potentiostatはどのように機能しますか(一言で言えば)?
前に述べたように、ポテンショスタットは作用電極の電位を制御し、それを流れる電流を測定します。
なぜ二つの電極だけではないのですか? その理由の1つは、電極が2つしかない場合、固定点に対する作用電極の電位を測定できないことです。
既に述べた作用電極と電極からなる二電極系を想像してみてください。
これらの電極の間に一定の電位を印加し、作用電極で電気化学反応が起こるが、回路を閉じて電流を流す必要があるため、作用電極での反応とは逆の反応、すなわち作用電極で酸化が起こる場合は基準電極で還元が行われなければならない。
定電位で電流が流れる場合は、ファラデーの法則に従って電気化学反応が起こる必要があります:
式3.1|ファラデーの法則
この式は、電極を流れる電荷Qは、電極でz電子を取ったり与えたりした種の量nに比例することを示しています。 Fはファラデー定数であり、1molの電子の電荷を表す。 電流Iは、電極を流れる時間tあたりの電荷Qです:
方程式3.2
式3.1および3.図2の組み合わせは、流れる電流Iが、量nを介して電極で起こっている反応に接続されていることを示しています:
方程式3.3
電流が基準電極に流れていることを想像してみてください。 この電極では、種の量のnが変換される。 この変換は、電極の周囲の溶液の表面または濃度の変化をもたらす。 ネルンスト方程式は、電極の電位Eとその周囲の間に明確な相関関係を示しています:

式3.4/ネルンスト方程式
E0は、酸化還元カップルRedとOxの標準電位です。 Rは気体定数、Tは温度です。 周囲の溶液中の種aOxおよびaRedの酸化および還元形態の活性は、必ずしも予測するのが容易ではない。 これは、多くの場合、方程式の簡素化につながります:

方程式3.5
2つの活性係数fOxとfRedは、結果として得られるポテンシャルE0’に含まれ、これは形式ポテンシャルと呼ばれます。 温度や活動係数などの環境に依存するパラメータが含まれているため、E0’はリストできませんが、必要に応じて実験ごとに決定する必要があります。 分析化学におけるほとんどの実験は、室温(295K)で行われる。 これにより、別の単純化が可能になります。 利便性のために、lnもログに転送されます。
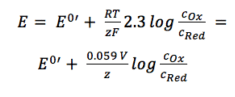
方程式3.6
実用的な応用のために、式3.6はネルンスト方程式の最も使用される形式です。 多くの用途では、両方の活性係数が1に近いため、E0はe0’とほぼ同じであると仮定することができます。
この形式(式3.6)では、電極の周囲とその電位との相関がより容易に見える。
前に述べたように、式3.4でのすべての簡略化が行われました。 しかし、すべての制限は、私たちが調査したいプロセス、つまり作業電極(WE)でのプロセスによって引き起こされるべきであるため、基準電極(RE)を通る電
この問題の解決策は第三の電極です。 補助電極としても知られているこの対向電極(C E)では、作用電極の反応に対する対向反応が起こる。 電流は作用電極と対向電極との間を流れている。 電位は、作動電極と基準電極の間で制御されます(図3.1を参照)。

図3.1/a概略三電極システム
対向電極と基準電極との間の電位は、作用電極と基準電極との間の一定の電位で作用電極を流れる電流が満たさ ポテンショスタットがREとWE(DC電位範囲)とCEとWE(コンプライアンス電圧)の間に適用できる電位には限界があります。
REとWEの間の電位を制御するので、DC電位範囲の限界内にとどまるのは簡単です。 準拠電圧はユーザーが制御できないため、CEはWEよりも大きくする必要があります。 同じ電位でより大きな表面がより高い電流につながり、CEはコンプライアンス電圧に入らずに十分な電流を供給する必要があります。
経験則では、CEはWEの100倍大きくする必要があることが示唆されています。 多くの実験ではこれは必要ではないかもしれませんが、良い練習のためには、CEがWEに流れる電流を制限しないように十分に大きいことを確認する
通常、CEとWEの間の距離は十分に大きいので、二つの電極の反応は互いに影響を及ぼさず、反反応は無視することができますが、例えば少量では、対極でどの反応が起こるかを知ることが有用であることがあります。