Hvordan Virker En Potentiostat Arbeid (i et nøtteskall)?
som nevnt før styrer en potensiostat potensialet til arbeidselektroden og måler strømmen som strømmer gjennom den.
Hvorfor ikke bare to elektroder? En av grunnene er at vi ikke kan måle potensialet til arbeidselektroden mot et fast punkt når vi bare har to elektroder.
Tenk deg et to-elektrodesystem som består av den allerede nevnte arbeidselektroden og elektroden, hvilket potensial skal være vårt faste referansepunkt, referanseelektroden.
vi bruker et visst potensial mellom disse elektrodene, og en elektrokjemisk reaksjon skjer ved arbeidselektroden, men siden kretsen må lukkes og strømmen må strømme, må en reaksjon som er invers til reaksjonen ved arbeidselektroden forekomme, det vil si hvis oksidasjon oppstår ved arbeidselektroden, må en reduksjon finne sted ved referanseelektroden.
hvis en strøm flyter med et konstant potensial, må en elektrokjemisk reaksjon skje I Henhold Til Faradays lov:
Ligning 3.1 / Faradays Lov
denne ligningen sier at ladningen Q som strømmer gjennom en elektrode er proporsjonal med mengden n av en art som tok eller ga z elektroner ved elektroden. F Er Faraday-konstanten og representerer ladningen på 1 mol elektroner. Strømmen I er ladningen Q per gang t strømmer gjennom elektroden:
Ligning 3.2
ligningene 3.1 og 3.2 kombinasjon viser at strømmen i flyter er koblet til reaksjonen som skjer ved elektroden via mengden n:
Ligning 3.3
Tenk deg nå at strømmen flyter ved referanseelektroden. Ved denne elektroden konverteres en art mengde n. Denne konverteringen fører til endring av overflaten eller konsentrasjonen av løsningen rundt elektroden. Nernst-ligningen viser en klar sammenheng mellom potensiell e av en elektrode og dens omgivelser:

Ligning 3.4 / Nernst ligning
E0 er standardpotensialet til redoksparet Rød Og Okse. R er gasskonstanten Og t temperaturen. Aktiviteten til den oksiderte og reduserte formen av arten aOx og aRed i den omkringliggende løsningen er ikke alltid lett å forutsi. Dette fører ofte til en forenkling av ligningen:

Ligning 3.5
de to aktivitetskoeffisientene fOx og fRed er inkludert i det resulterende potensialet E0′, som kalles det formelle potensialet. Siden det inneholder parametere som er avhengige av miljøet, for eksempel temperatur-og aktivitetskoeffisienter, Kan E0 ‘ ikke listes opp, men må bestemmes for hvert eksperiment, om nødvendig. De fleste eksperimenter i analytisk kjemi utføres ved romtemperatur (295 K). Dette gjør en annen forenkling mulig. Av bekvemmelighet blir også ln overført til loggen.
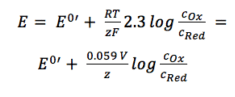
Ligning 3.6
for praktisk anvendelse er ligning 3.6 Den mest brukte formen Av nernst-ligningen. For mange applikasjoner kan man anta At E0 er omtrent det samme Som E0′, fordi begge aktivitetskoeffisientene er nær en.
i denne formen (ligning 3.6) er korrelasjonen mellom omgivelsene til en elektrode og dens potensial synlig lettere.
som nevnt før ble alle forenklingene ved ligning 3.4 utført: endringen av løsningen rundt referanselektroden, på grunn av en flytende strøm, fører til en endring av potensialet som skal være vårt faste referansepunkt. Men vi kan ikke begrense strømmen gjennom referanseelektroden (RE), fordi alle begrensninger skal skyldes prosessen som vi vil undersøke, det er prosessen ved arbeidselektroden (VI).
løsningen på dette problemet er en tredje elektrode. VED DENNE motelektroden (CE), også kjent som hjelpelektroden, finner motreaksjonen til arbeidselektrodens reaksjoner sted. Strømmen flyter mellom arbeids-og motelektroden. Potensialet styres mellom arbeids-og referanseelektroden (Se Figur 3.1).

Figur 3.1 / et skjematisk tre elektrodesystem
potensialet mellom teller-og referanseelektroden justeres på en slik måte at strømmen som strømmer gjennom arbeidselektroden ved et visst potensial mellom arbeids-og referanseelektrode er oppfylt. Det er grenser for potensialet et potensiostat kan gjelde mellom RE OG VI (DC potential range) og CE og VI (compliance voltage).
Siden du kontrollerer potensialet MELLOM RE OG VI, er det lett å holde seg innenfor GRENSENE FOR DC-potensialområdet. CE må være større ENN VI, fordi samsvarsspenningen ikke kan styres av brukeren. En større overflate med samme potensial fører til høyere strøm, OG CE skal gi nok strøm uten å løpe inn i samsvarsspenningen.
en tommelfingerregel antyder at CE skal være 100 ganger større ENN VI. For mange eksperimenter kan dette ikke være nødvendig, men for en god praksis bør du sørge for AT CE er stor nok slik at den ikke begrenser strømmen som strømmer PÅ VI.
vanligvis er avstanden MELLOM CE OG VI stor nok, slik at reaksjonene til de to elektrodene ikke påvirker hverandre, og motreaksjonen kan ignoreres, men noen ganger, i små volumer for eksempel, kan det være nyttig å vite hvilken reaksjon som skjer ved motelektroden.